题目内容
5.某强酸性溶液X中含有NH4+、A13+、Ba2+、Fe2+、CO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行如下实验:下列有关推断合理的是( )
| A. | 溶液中一定没有Ba2+、NO3-、CO32- | |
| B. | 溶液中一定含有H+、NH4+、Fe2+、SO42-、Cl- | |
| C. | 沉淀H为一定Al(OH)3和BaCO3的混合物 | |
| D. | 若溶液X的体积为100 mL,产生标况下112 mL气体A,则X中c(Fe2+)=0.05mol•L-1 |
分析 在强酸性溶液中一定不会存在CO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,那么一定含有SO42-离子,一定不含Ba2+离子,不能确定是否含有的离子Cl-,以此解答该题.
解答 解:在强酸性溶液中一定不会存在CO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,那么一定含有SO42-离子,一定不含Ba2+离子,不能确定是否含有的离子Cl-,
A.由以上分析可知溶液中一定没有Ba2+、NO3-、CO32-,故A正确;
B.题中实验不能确定是否含有Cl-,故B错误;
C.通入过量二氧化碳,不可能生成BaCO3,沉淀只有Al(OH)3,故B错误;
D.生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为112 mL,物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)=$\frac{0.015mol}{0.1L}$=0.15mol/L,故D错误,
故选A.
点评 本题考查了常见离子的检验、无机推断,为高考常见题型,综合考查元素化合物知识以及离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 糖类、蛋白质、合成橡胶都是高分子化合物 | |
| D. | 甲苯、乙烯、聚乙烯都能使酸性KMnO4溶液褪色 |
| A. | 对应简单离子半径的大小顺序为:D>B>A | |
| B. | C的最高价氧化物对应水化物的酸性比D的强 | |
| C. | A分别与B、C形成的化合物中化学键类型相同 | |
| D. | B、C单质均能和氢氧化钠溶液发生反应生成氢气 |
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
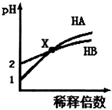
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
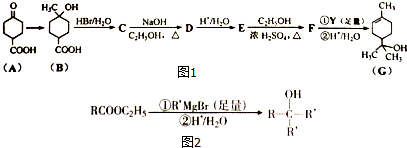
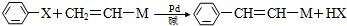 (X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: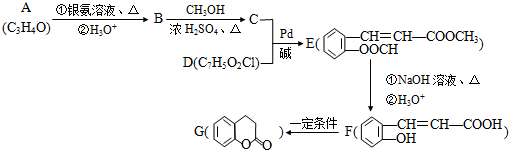
 .
.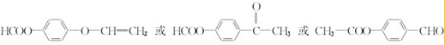 .
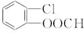
. )常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(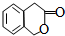 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液. (R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备
(R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备 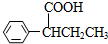 的合成路线流程图如下,请补充完整流程图(无机试剂任选).
的合成路线流程图如下,请补充完整流程图(无机试剂任选).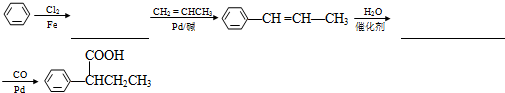
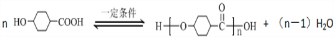 ;
; .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr.