题目内容
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
分析 A.光导纤维的主要成分是二氧化硅;
B.碳酸氢钠能够与盐酸反应,消耗盐酸,碳酸氢钠不稳定受热分解生成二氧化碳;
C.铝合金具有质量轻,强度大,抗腐蚀能力比较强的优点;
D.血液是胶体.
解答 解:A.信息产业中光纤的主要成分是二氧化硅,不是硅,故A错误;
B.碳酸氢钠分解生成碳酸钠,能够制造纯碱,碳酸氢钠能够与盐酸反应消耗盐酸,能够治疗胃酸过多,碳酸氢钠不稳定受热分解生成二氧化碳,可用作发酵,故B正确;
C.铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性,铝合金材料的密度小,用以减轻列车质量,铝合金强度大,所以高铁车厢大部分材料采用铝合金,故C正确;
D.血液是胶体,不能透过半透膜,代谢产生的废物是离子或小分子能透过半透膜,故D正确;
故选:A.
点评 本题为综合题,考查了物质的用途、合金的性质、胶体,明确硅及二氧化硅性质和用途差别是解题关键,注意合金的性质,题目难度不大.

练习册系列答案
相关题目
1.某有机物X的结构简式如图所示,则下列有关说法中正确的是( )


| A. | X的分子式为C5H10O2,该产物属于羧酸的同分异构体有5种 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 | |
| D. | 可用酸性高锰酸钾溶液区分苯和X |
18.海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构.用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的.海水中只含有0.5%的溶解氧.不放入海洋时,铝极就不会在空气中被氧化,可以长期储存.用时,把电池放入海水中,便可供电,电池设计使用周期可长达一年以上,避免经常交换电池的麻烦.即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是( )
| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
5.某强酸性溶液X中含有NH4+、A13+、Ba2+、Fe2+、CO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行如下实验:下列有关推断合理的是( )
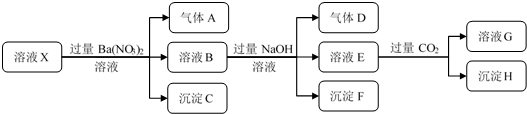

| A. | 溶液中一定没有Ba2+、NO3-、CO32- | |
| B. | 溶液中一定含有H+、NH4+、Fe2+、SO42-、Cl- | |
| C. | 沉淀H为一定Al(OH)3和BaCO3的混合物 | |
| D. | 若溶液X的体积为100 mL,产生标况下112 mL气体A,则X中c(Fe2+)=0.05mol•L-1 |
15.下列实验装置正确并能达到实验目的是( )
| A. |  用于制氨气并收集干燥的氨气 | |
| B. | 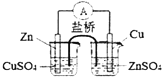 是实现化学能转化为电能的铜锌原电池的原理示意图 | |
| C. | 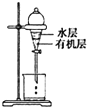 是用CCl4提取碘水中的I2 | |
| D. |  用于配制100mL0.2mo1•L-1的硫酸溶液 |
2.饱和一元醇R(C5H12O)以银为催化剂进行催化氧化得醛M,再经过酸性KMnO4氧化最终得到羧酸N,则R与N最多可形成酯( )
| A. | 9种 | B. | 16种 | C. | 32种 | D. | 64种 |
19.美国普林斯顿大学的研究人员利用太阳能电池,通过电解的方法成功地将二氧化碳和水转化为甲酸(HCOOH).下列说法不正确的是( )
| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
20.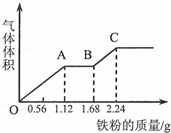 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
 燃烧是我们非常熟悉的化学反应.
燃烧是我们非常熟悉的化学反应.