6.镭是元素周期中第七周期ⅡA族元素,下列关于镭的性质的描述中,不正确的是( )
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 硫酸盐难溶于水 | D. | 镭比钙的金属性强 |
5.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | |
| B. | 酸性:HClO4>H2SO4>H3PO4 | |
| C. | 与同浓度的稀盐酸反应剧烈程度:Mg>Al | |
| D. | 热稳定性:HF>H2O>NH3 |
4.在密闭容器中进行X2(气)+2Y2(气)?Z(气)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(Y2)=0.5mol/L | C. | c(X2)=0 | D. | c(X2)=0.5mol/L |
3.氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
(1)写出下列元素的名称:B氧,E氯;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
20.下列说法中,正确的是( )
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 有机化合物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 | |
| D. | 加热铝使之熔化克服的是共价键 |
19.已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
17.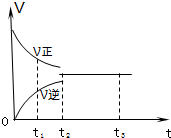 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
0 167786 167794 167800 167804 167810 167812 167816 167822 167824 167830 167836 167840 167842 167846 167852 167854 167860 167864 167866 167870 167872 167876 167878 167880 167881 167882 167884 167885 167886 167888 167890 167894 167896 167900 167902 167906 167912 167914 167920 167924 167926 167930 167936 167942 167944 167950 167954 167956 167962 167966 167972 167980 203614
 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应没有逆方向反应 | |
| B. | t2时,反应已达到平衡状态 | |
| C. | t2-t3,各物质的浓度不再发生变化 | |
| D. | t2-t3,处于静止状态,反应不再发生 |
 W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题: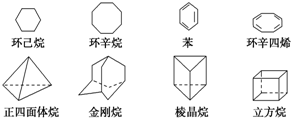 下列是八种环状的烃类物质:
下列是八种环状的烃类物质: