题目内容
3.氯化钠是日常生活中人们常用的调味品.下列性质可以证明氯化钠中一定存在离子键的是( )| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
分析 离子化合物中一定含有离子键,要证明氯化钠中一定含有离子键,只要证明熔融态氯化钠能导电即可,据此分析解答.
解答 解:A.能溶于水的物质不一定含有离子键,如氨气、HCl等,故A错误;
B.水溶液能导电的物质不一定含有离子键,如硫酸、硝酸等,故B错误;
C.熔沸点较高的物质不一定含有离子键,如钨丝、金刚石等,故C错误;
D.离子化合物在熔融态能电离出自由移动的阴阳离子而导电,共价化合物熔融态以分子存在而不导电,故D正确;
故选D.
点评 本题考查离子键的判断,侧重考查基本概念,可以根据离子化合物和共价化合物熔融态是否导电判断,注意不能根据溶解性强弱、水溶液导电能力强弱判断,为易错点.

练习册系列答案
相关题目
14.炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=Q kJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
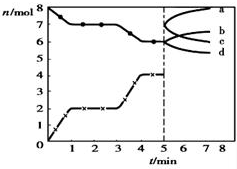

| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
8.一定条件下,H2O2在水溶液中发生分解反应:2H2O2 $\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
(1)H2O2的分解反应是氧化还原反应(填“是”或“不是”).
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1min-1.
(3)如果反应所用的H2O2溶液为100mL,则0─80min共产生O2Cg.
A.0.08 B.0.16 C.1.2 D.2.4.
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─20min的平均反应速率v(H2O2)为0.02mol•L-1min-1.
(3)如果反应所用的H2O2溶液为100mL,则0─80min共产生O2Cg.
A.0.08 B.0.16 C.1.2 D.2.4.
15.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
12.能用浓硫酸干燥的气体是( )
| A. | HI | B. | NH3 | C. | SO2 | D. | H2S |
13.如表除去括号内杂质所用的试剂和方法都正确的是( )
| 选项 | 物质 | 所用试剂 | 方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙醇(水) | 生石灰 | 分液 |
| C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用:
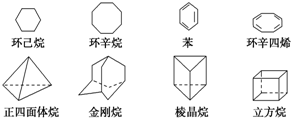 下列是八种环状的烃类物质:
下列是八种环状的烃类物质: