题目内容
20.下列说法中,正确的是( )| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 有机化合物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 | |
| D. | 加热铝使之熔化克服的是共价键 |
分析 A.HCl中只含共价键;
B.碘晶体受热转变成碘蒸气,化学键不变;
C.CH3-CH2-NO2和H2N-CH2-COOH的分子式相同,结构不同;
D.Al为金属晶体.
解答 解:A.HCl中只含共价键,为共价化合物,化氢溶于水能电离出H+、Cl-,故A错误;
B.碘晶体受热转变成碘蒸气,化学键不变,只克服分子间作用力,故B错误;
C.CH3-CH2-NO2和H2N-CH2-COOH的分子式相同,结构不同,互为同分异构体,故C正确;
D.Al为金属晶体,加热铝使之熔化克服的是金属键,故D错误;
故选C.
点评 本题考查较综合,涉及化学键、同分异构体等,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意物质中的化学键分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物.
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物.
| A. | ①③⑥ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑤ |
8.下列表示对应化学反应的离子方程式正确的是( )
| A. | 铜和浓硝酸反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化铜溶于硝酸:2H++Cu(OH)2=Cu2++2H2O | |
| D. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
5.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | |
| B. | 酸性:HClO4>H2SO4>H3PO4 | |
| C. | 与同浓度的稀盐酸反应剧烈程度:Mg>Al | |
| D. | 热稳定性:HF>H2O>NH3 |
12.下列各组中的微粒均含有配位键的是( )
| A. | H2O、Al2Cl6 | B. | CO2、SO42- | ||
| C. | PCl5、[Co(NH3)4Cl2]Cl | D. | NH4Cl、[Cu(NH3)4]SO4 |
9.以下物质属于弱电解质的是( )
| A. | 盐酸 | B. | CH3COONH4 | C. | CH3COOH | D. | CI2 |
10.下列关于有机物的叙述正确的是( )
| A. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| B. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同种物质 | |
| D. | 羧基、醛基、羟基、乙基都属于有机物的官能团 |
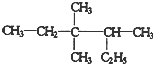 3,3,4-三甲基已烷
3,3,4-三甲基已烷 、
、 .
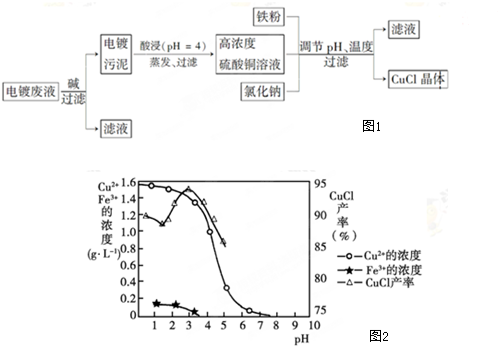
. ,则其分子式为C10H16,该烃的一溴取代物有2种.
,则其分子式为C10H16,该烃的一溴取代物有2种. .
.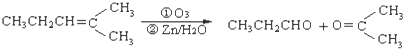 上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成
上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成 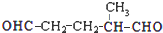 ,则烃A的结构可表示为
,则烃A的结构可表示为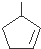 .
.