题目内容
2. W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:(1)W、Y、Z、M形成的简单离子的半径大小顺序是S2->O2->Na+>H+(用化学符号表示).
(2)Y与M的氢化物中,热稳定性更好的是H2O(填化学式),原因是O的非金属性大于S.
(3)Z2Y2和水反应时破坏的化学键有共价键、离子键.
(4)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子.X4分子结构如图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量.根据以上信息和数据,下列说法正确的是C.
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(5)已知X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式N2H4-4e-+4OH-═N2↑+4H2O.
分析 W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,X元素的气态氢化物水溶液呈碱性,则X为N元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为O元素,W、Z同主族,可形成离子化合物ZW,Z的原子序数小于S,应为Na元素,G原子序数大于S原子序数,则G为Cl元素,以此解答该题.
解答 解:W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,X元素的气态氢化物水溶液呈碱性,则X为N元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为O元素,W、Z同主族,可形成离子化合物ZW,Z的原子序数小于S,应为Na元素,G原子序数大于S原子序数,则G为Cl元素,
(1)离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,应为S2->O2->Na+>H+,
故答案为:S2->O2->Na+>H+;
(2)非金属性O>S,非金属性越强,对应的氢化物的稳定性越强,故答案为:H2O;O的非金属性大于S;
(3)Na2O2和水反应生成氢氧化钠和氧气,反应破坏共价键、离子键,故答案为:共价键、离子键;
(4)A.X4沸点比P4(白磷)低,属于分子晶体,故A错误;
B.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故B错误;
C.X4与X2都由同种元素构成的不同单质,为同素异形体,故C正确.
故答案为:C;
(5)肼-空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-═N2↑+4H2O,正极上发生得电子的还原反应,即2H2O+O2+4e-═4OH-,故答案为:N2H4-4e-+4OH-═N2↑+4H2O.
点评 本题考查结构性质位置关系应用,为高频考点,涉及半径比较、元素周期律、原电池、元素化合物推断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.

 阅读快车系列答案
阅读快车系列答案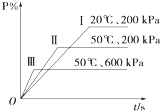 在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )| A. | 正反应放热,L是固体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应吸热,L是固态 | D. | 正反应放热,L是固体或气体 |
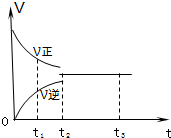 如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应3X2+Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应没有逆方向反应 | |
| B. | t2时,反应已达到平衡状态 | |
| C. | t2-t3,各物质的浓度不再发生变化 | |
| D. | t2-t3,处于静止状态,反应不再发生 |
| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
| A. | SO2通入品红溶液 | B. | 碘酒滴入淀粉溶液 | ||
| C. | 乙烯通入酸性KMnO4溶液中 | D. | Cl2通入NaOH溶液中 |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl是取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br是加成反应 | |
| C. | 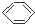 +HO-NO2$→_{60℃}^{浓硫酸}$ +HO-NO2$→_{60℃}^{浓硫酸}$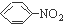 +H2O是取代反应 +H2O是取代反应 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O是加成反应 |
 现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:
现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作: