题目内容
4.在密闭容器中进行X2(气)+2Y2(气)?Z(气)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )| A. | c(Z)=0.45mol/L | B. | c(Y2)=0.5mol/L | C. | c(X2)=0 | D. | c(X2)=0.5mol/L |
分析 该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,采用极限法分析解答.
解答 解:该反应可能向正反应方向移动也可能向逆反应方向移动,如果向正反应方向移动,则反应物浓度最小、生成物浓度最大,如果向逆反应方向移动,则反应物浓度最大、生成物浓度最小,
假设Y2完全转化为Z,完全反应后则c(Y2)=0、c(X2)=(0.2-0.15)mol/L=0.05mol/L、c(Z)=0.3mol/L+0.15mol/L=0.45mol/L;
假设Z完全转化为生成物,完全反应后c(Z)=0、c(Y2)=0.3mol/L+0.6mol/L=0.9mol/L、c(X2)=(0.2+0.3)mol/L=0.5mol/L,
实际上存在平衡状态,所以c(X2)为0.05mol/L-0.5mol/L、c(Y2)为0-0.9mol/L、c(Z)在0-0.45mol/L,
所以只有B符合,故选B.
点评 本题考查化学平衡建立过程,明确可逆反应特点是解本题关键,利用极限法分析解答即可,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
14. 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
(1)判断滴定终点的现象:溶液恰好由浅红色变成无色,且半分钟内不恢复.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
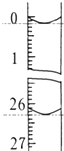
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10ml.
(4)某学生根据3次实验分别记录有关数据如表:
①平均耗用盐酸体积V=27.35mL
②依据上表数据计算该NaOH溶液的物质的量浓度0.1046mol/l (计算结果取4位有效数).
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:(1)判断滴定终点的现象:溶液恰好由浅红色变成无色,且半分钟内不恢复.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10ml.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.15 |
| 第二次 | 25.00 | 0.56 | 30.30 |
| 第三次 | 25.00 | 0.20 | 26.35 |
②依据上表数据计算该NaOH溶液的物质的量浓度0.1046mol/l (计算结果取4位有效数).
15.下列关于反应速率的说法正确的是( )
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
12.下列分子式表示的物质一定是纯净物的是( )
| A. | CH2Cl2 | B. | C2H6O | C. | C3H6 | D. | C2H4Cl2 |
19.已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
9.下列说法正确的是( )
| A. | 只用一种试剂就可以鉴别甲苯、乙醇和四氯化碳 | |
| B. | 若两种烃中碳、氢元素的质量分数分别相同,它们必定是同系物 | |
| C. | CH3-CH=CH2分子中所有原子一定处于同一平面 | |
| D. | 某烷烃的命名为3,4,4-三甲基己烷 |
16.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>d | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
13.如表是元素周期表的一部分,根据所给的10 种元素,回答下列问题.
(1)金属性最强的元素是Na,最稳定的气态氢化物是HF(填化学式),适合制造半导体材料的元素是Si;
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
(2)表中所列第三周期的元素中,原子半径最小的是Cl,这些元素形成的简单离子中,离子半径最小的是Al3+(填离子符号);
(3)元素最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式),能证明Al(OH)3具有两性的实验是b(或bc、cd、bd)(填序号);
a.向AlCl3溶液中加入过量氨水
b.将铝条放入NaOH溶液中
c.向Al(OH)3浊液中滴入过量盐酸
d.向NaOH溶液中滴入少量AlCl3溶液
(4)举出能证明非金属性Cl>S的实验事实(举一例即可)氯气通入氢硫酸溶液中置换出硫.
14. 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )
①能发生氧化反应;②能使溴水褪色;③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加成反应;⑥能发生银镜反应.
 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )①能发生氧化反应;②能使溴水褪色;③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加成反应;⑥能发生银镜反应.
| A. | 只有②④ | B. | 只有②③④ | C. | 只有①②③④⑤ | D. | 全部 |