题目内容
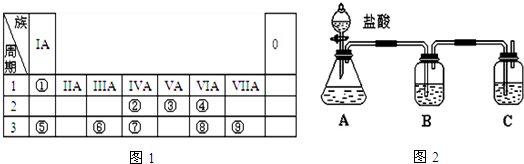
5.在通常条件下,下列各组物质的性质排列不正确的是( )| A. | 熔点:CO2>KCl>SiO2 | |
| B. | 酸性:HClO4>H2SO4>H3PO4 | |
| C. | 与同浓度的稀盐酸反应剧烈程度:Mg>Al | |
| D. | 热稳定性:HF>H2O>NH3 |
分析 A、晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C、金属性越强与酸反应越剧烈;
D、元素的非金属性越强,对应的氢化物越稳定.
解答 解:A、晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>KCl>CO2,故A错误;
B、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性强弱为:HClO4>H2SO4>H3PO4,故B正确;
C、因为镁金属性比铝强,所以镁与酸反应剧烈,故C正确;
D、非金属性F>O>N,元素的非金属性越强,对应的氢化物越稳定,所以稳定性HF>H2O>NH3,故D正确;
故选A.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
相关题目
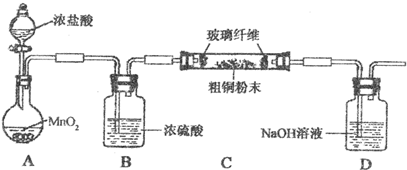
16.87g MnO2与含HCl为146g的浓盐酸共热在不考虑HCl挥发的情况下得到的Cl2为( )
| A. | 142g | B. | 71g | C. | 小于71 g | D. | 大于142 g |
13.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用裂化汽油从碘水中提取碘 |
20.下列说法中,正确的是( )
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 有机化合物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 | |
| D. | 加热铝使之熔化克服的是共价键 |

 ;
;
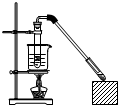 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到饱和碳酸钠溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到饱和碳酸钠溶液的液面上.
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.