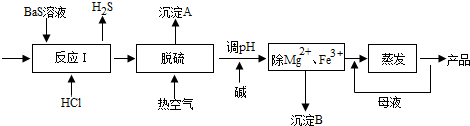
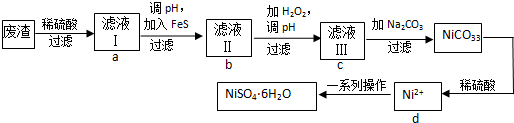
16.下列说法中错误的是( )
| A. | 燃烧、酸碱中和反应都是放热反应 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
15.复合材料制成的防弹头盔能抵御多种手枪子弹的射击,最大限度地保护使用人员的安全,下列有关复合材料的性质中,与这一用途有关的是( )
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
14.下列说法正确的是( )
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
13.100mL 6mol•L-1H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | Na2CO3固体 | B. | NaCl溶液 | C. | 浓H2SO4 | D. | KNO3溶液 |
12.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是( )
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
11.下列有关元素周期表、元素周期律的说法中不正确的是( )
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |
7.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )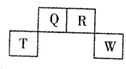
0 167781 167789 167795 167799 167805 167807 167811 167817 167819 167825 167831 167835 167837 167841 167847 167849 167855 167859 167861 167865 167867 167871 167873 167875 167876 167877 167879 167880 167881 167883 167885 167889 167891 167895 167897 167901 167907 167909 167915 167919 167921 167925 167931 167937 167939 167945 167949 167951 167957 167961 167967 167975 203614

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |