题目内容
7.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |
分析 由元素在周期表中的位置可知,Q、R在元素周期表第二周期,T、W在元素周期表第三周期,由题意可知,T元素为金属,T为金属铝,Q为碳元素、R为氮元素、W为硫元素.
A、非金属性越强,对应气态氢化物越稳定;
B、元素T的离子即为铝离子的结构示意图而R的离子半径氮离子,两者电子层数相同,核电荷数越大半径越小;
C、同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,因此成键的原子都不显电性.这样的共价键叫做非极性共价键,相同原子形成的共价键为非极性键;
D、Q的酸性氧化物是否不至一种,Q是碳.
解答 解:由元素在周期表中的位置可知,Q、R在元素周期表第二周期,T、W在元素周期表第三周期,由题意可知,T元素为金属,T为金属铝,Q为碳元素、R为氮元素、W为硫元素.
A、非金属性越强,对应气态氢化物越稳定R的非金属性比Q的非金属性强,故气态氢化物稳定性:R>Q,故A正确;
B、元素T的离子即为铝离子的结构示意图而R的离子半径氮离子,两者电子层数相同,核电荷数越大半径越小,所以元素T的离子半径<元素R的离子半径,故B错误;
C、与S同主族的某元素形成的18电子的氢化物分子,即H2O2分子中既有H-O极性键又有O-O非极性键,故C正确;
D、Q是碳,可以形成无机碳酸和有机羧酸如甲酸,草酸等,故D正确;
故选:B.
点评 本题考查物质结构与性质,涉及元素周期表、元素周期律、共价键的极性、分子结构与性质难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
19.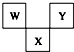 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
12.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是( )
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
19.下列物质中,一定与CH2=CH(CH2)3CH3互为同系物的是( )
| A. | C2H4 | B. | C4H8 | C. | (CH3)2C=CHCH2CH3 | D. | CH2=CHCH2CH=CH2 |
16.87g MnO2与含HCl为146g的浓盐酸共热在不考虑HCl挥发的情况下得到的Cl2为( )
| A. | 142g | B. | 71g | C. | 小于71 g | D. | 大于142 g |



 ;
;