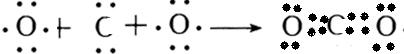题目内容
9.NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: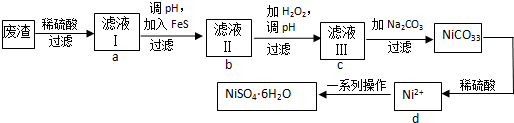
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为:FeS+Cu2+=CuS+Fe2+.
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
②调滤液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O?Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=3.6×10-4.
③检验Fe3+是否除尽的操作和现象是:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净.
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4•6H2O晶体,请回答:
①在进行蒸发浓缩操作时,加热到溶液表面形成晶体薄膜(描述实验现象),则停止加热.
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的d位置.(填a、b、c、d)
③如果得到产品的纯度不够,则应该进行重结晶操作(填操作名称).
分析 废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+;
②然后调pH沉淀Fe3+,Fe3++3H2O?Fe(OH)3+3H+,依据水解平衡常数Kh=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$×($\frac{c(O{H}^{-})}{c(O{H}^{-})}$)3=$\frac{(Kw)^{3}}{Ksp}$计算得到;
③依据铁离子遇到KSCN溶液呈红色设计实验检验是否除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
(4)①在进行蒸发浓缩操作时,当大量晶体析出时,停止加热;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体;
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+;
故答案为:FeS+Cu2+=CuS+Fe2+;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,加入H2O2的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2 H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2 H2O;
②调滤液ⅡpH的目的是除去Fe3+,Fe3++3H2O?Fe(OH)3+3H+,依据水解平衡常数Kh=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$×($\frac{c(O{H}^{-})}{c(O{H}^{-})}$)3=$\frac{(Kw)^{3}}{Ksp}$=$\frac{(1{0}^{-14})^{3}}{2.8×1{0}^{-39}}$≈3.6×10-4;
故答案为:3.6×10-4;
③检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
故答案为:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
(4)①在进行蒸发浓缩操作时,当大量晶体析出时或溶液表面形成晶体薄膜,停止加热;
故答案为:溶液表面形成晶体薄膜或者有大量晶体析出;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用,
故答案为:d;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体,实验操作为重结晶;
故答案为:重结晶;
点评 本题考查物质的分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

 名校课堂系列答案
名校课堂系列答案| A. | 原子的最外层有两个电子的元素并不都在第ⅡA族 | |
| B. | 第ⅠA族元素都是典型的金属元素 | |
| C. | 第ⅦA族的元素最外层都有七个电子 | |
| D. | 第三周期的元素的原子核外都有三个电子层 |
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 同一周期中,卤族元素的第一电离能最大 |
| A. | CH3F的电子式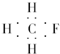 | B. | Na2S的电子式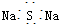 | C. | 氢氧根的电子式 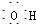 | D. | 次氯酸的电子式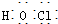 |
| A. | 先与Cl2加成,再与Br2加成 | B. | 先与Cl2加成,再与HBr加成 | ||
| C. | 先与HCl加成,再与Br2加成 | D. | 先与HCl加成,再与HBr加成 |
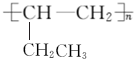 .
. 氯化铵
氯化铵 氢氧化钠
氢氧化钠
 ,二氧化碳
,二氧化碳