题目内容
13.100mL 6mol•L-1H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )| A. | Na2CO3固体 | B. | NaCl溶液 | C. | 浓H2SO4 | D. | KNO3溶液 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,锌与浓硫酸以及硝酸反应不生成氢气,以此来解答.
解答 解:A.碳酸钠与酸反应,生成氢气的量减少,故A错误;
B.加入NaCl溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故B正确;
C.浓硫酸与锌反应不生成氢气,故C错误;
D.加硝酸钠,氢离子、硝酸根离子与Zn发生氧化还原反应不生成氢气,减少生成氢气的量,故D错误.
故选B.
点评 本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,题目难度不大,注意锌与浓硫酸以及硝酸反应不生成氢气.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.某试管中充满红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原来试管中盛装的气体判断不正确的是( )
| A. | 可能是N2与NO2的混和气体 | B. | 可能是N2与NO的混和气体 | ||
| C. | 可能是NO与NO2的混和气体 | D. | 可能是NO2一种气体 |
1.七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用.利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁,硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等).
表1 部分阳离子以氢氧化物形式完全沉淀时的pH
表2 两种盐的溶解度(单位为 g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如下:
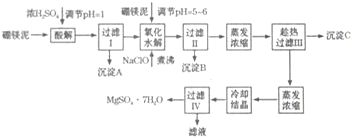
根据以上流程图并参考表格pH和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是bc(选填序号).
a.被钝化 b.被氧化 c.被溶解
(2)过滤1的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaCLO溶液加热煮沸,其目的有:①将溶液中的Mn2+氧化成MnO2,该反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-.②将Fe2+氧化为Fe3+,该反应的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3等物质(填化学式)
(4)沉淀C的化学式是CaSO4•2H2O或CaSO4,过滤Ⅲ需趁热过滤的理由是防止MgSO4在温度降低时结晶析出.
表1 部分阳离子以氢氧化物形式完全沉淀时的pH
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

根据以上流程图并参考表格pH和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是bc(选填序号).
a.被钝化 b.被氧化 c.被溶解
(2)过滤1的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaCLO溶液加热煮沸,其目的有:①将溶液中的Mn2+氧化成MnO2,该反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-.②将Fe2+氧化为Fe3+,该反应的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)沉淀B中除MnO2、SiO2外还含有Fe(OH)3、Al(OH)3等物质(填化学式)
(4)沉淀C的化学式是CaSO4•2H2O或CaSO4,过滤Ⅲ需趁热过滤的理由是防止MgSO4在温度降低时结晶析出.
5.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
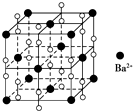

| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
2.分子间存在着分子作用间力的实验事实是( )
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
3.已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同电子层结构,下列关系正确( )
| A. | 原子半径:B<A | B. | 离子的还原性:C2->D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 质子数:c>b |
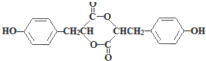 )的路线如下图所示:
)的路线如下图所示: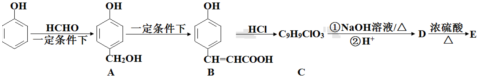
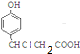 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$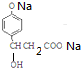 +NaCl+2H2O;
+NaCl+2H2O; 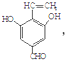 ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式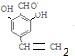 、
、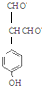 .
.