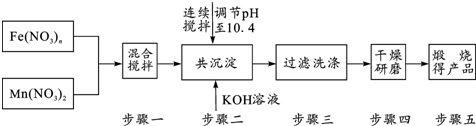
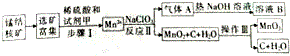
题目内容
12.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是( )| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.未用标准液润洗碱式滴定管,标准液浓度偏小,滴定时消耗的NaOH偏多,则造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏高,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,则读数偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏小,故B错误;
C.锥形瓶未用待测液润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故C错误;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则滴加的标准溶液偏多,则造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知c(待测)偏高,故D正确;
故选AD.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |
4.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | NaCl的熔点比MgO的熔点高 | NaCl的晶格能比MgO的晶格能大 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
1.关于氢键,下列说法正确的是( )
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | 由于N、O、F的第一电离能较大,所以NH3、H2O、HF分子间可以形成氢键 | |
| C. | 只要有氢键,物质的熔点和沸点就会升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
2.下列递变规律正确的是( )
| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |