18.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
17.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
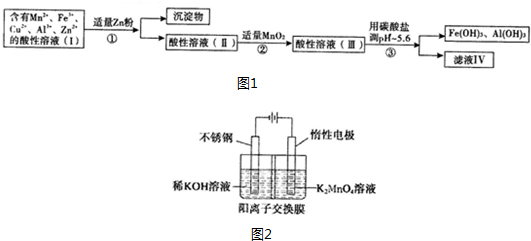
15.硫和硒(Se)、磷(Te)为同主族元素,在生产、生活中有着广泛用途.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:
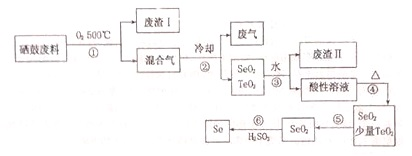
已知:
(1)硒的最高价氧化物对应水化合物化学式:H2SeO4;
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:

已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
13.研究NO2、SO2、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
①T1℃时,该反应的平衡常数K=0.56(保留两位小数).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.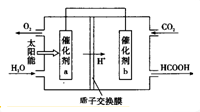 3×10-8mol•L-1)
3×10-8mol•L-1)
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.
 3×10-8mol•L-1)
3×10-8mol•L-1)(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
10.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
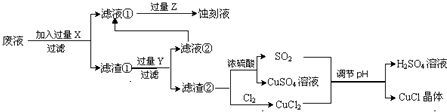
文字根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是离子交换膜电解槽.
(2)写出生产过程中X:Fe Y:HCl (填化学式).
(3)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是:防止CuCl水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体样品的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.
已知:CuCl+FeCl3═CuCl2+FeCl2
Fe2++Ce4+══Fe3++Ce3+
如此再重复二次测得:
④数据处理:计算得CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)
0 167724 167732 167738 167742 167748 167750 167754 167760 167762 167768 167774 167778 167780 167784 167790 167792 167798 167802 167804 167808 167810 167814 167816 167818 167819 167820 167822 167823 167824 167826 167828 167832 167834 167838 167840 167844 167850 167852 167858 167862 167864 167868 167874 167880 167882 167888 167892 167894 167900 167904 167910 167918 203614

文字根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是离子交换膜电解槽.
(2)写出生产过程中X:Fe Y:HCl (填化学式).
(3)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是:防止CuCl水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体样品的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.
已知:CuCl+FeCl3═CuCl2+FeCl2
Fe2++Ce4+══Fe3++Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
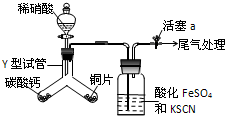 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.