题目内容
11.某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O2等物质)为原料制取Zn和MnO2.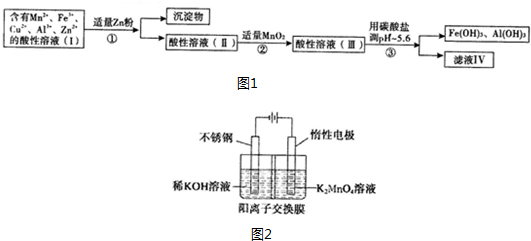
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
□MnO2+□ZnS+□H2SO4═□MnSO4+□Fe2(SO4)3+□S+□H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按图1的工业流程进行处理得到溶液(Ⅳ)、电解溶液(Ⅳ)即得MnO2和Zn.
a.操作中①中加Zn粉后发生反应的离子方程式为:Zn+Cu2+=Zn2++Cu、Zn+2Fe3+=Zn2++2Fe2+.
b.操作②中加入MnO2的作用是将Fe2+氧化为Fe3+;反应的离子方程式是MnO2+2Fe2++4H+=2Fe3++2H2O+Mn2+.
c.操作③中所加碳酸盐的化学式是MnCO3或ZnCO3.
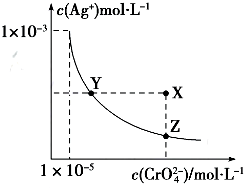
(3)电解法制备高锰酸钾的实验装置示意图(图中阳离子交换膜只允许K+离子通过):
①阳极的电极反应式为MnO42--e-=MnO4-.
②若电解开始时阳极区溶液为1.0L0.40mol/LK2MnO4溶液,电解一段时间后,溶液中$\frac{n(K)}{n(Mn)}$为6:5,阴极区生成生成KOH的质量为17.9.(计算结果保留3位有效数字)
(4)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33,
①在25℃下,向浓度均为0.1mol•L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成Al(OH)3沉淀(填化学式)
②用MgCl2和AlCl3的混合溶液(A)与过量氨水(B)反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入B反应物.
③溶液中某离子物质的量浓度低于1.0×10-5mol•L-1时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol•L-1.此时所得沉淀中不含有(填“还含有”或“不含有”)Al(OH)3.
分析 含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液,加适量Zn粉,Cu2+被还原为Cu,Fe3+被还原为Fe2+,过滤,滤渣为Cu,滤液中含有Mn2+、Fe2+、Al3+、Zn2+等,再加MnO2把Fe2+氧化为Fe3+,然后加入MnCO3或ZnCO3调节pH,使Fe3+和Al3+转化为Al(OH)3、Fe(OH)3沉淀,再过滤,滤渣为Al(OH)3、Fe(OH)3,滤液IV中还含有Mn2+、Zn2+;
(1)根据原子守恒和得失电子守恒配平方程式;
(2)a.锌可以Cu2+和Fe3+发生氧化还原反应;
b.在酸性条件下,MnO2可将Fe2+氧化成Fe3+;
c.溶液中不能引入新的杂质离子;
(3)①根据阳极失电子发生氧化反应书写电极反应式;
②根据阳极区反应,结合题给数据计算阳极区的K+定向移动到阴极区的物质的量,从而计算阴极区生成KOH的质量;
(4)①根据Al(OH)3、Cu(OH)2的溶度积常数,计算刚开始生成沉淀时,溶液中氢氧根离子的浓度,浓度小的先沉淀;
②向沉淀反应器中加入过量的氨水,Mg2+、Al3+同时生成沉淀;
③Fe3+完全沉淀时,c(OH-)3=$\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}$,Qc=c(Al3+)•(OH-)3,根据Qc与Ksp的相对大小判断.
解答 解:(1)反应中Mn元素的化合价降低2价,S元素的化合价升高2价,Fe的化合价升高1价,则反应的化学方程式为:3MnO2+2FeS+6H2SO4=3MnSO4+1Fe2(SO4)3+2S+6H2O,
故答案为:3;2;6;3;1;2;6;
(2)a.锌可以Cu2+和Fe3+反应,方程式为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+,
故答案为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+;
b.在酸性条件下,MnO2可将Fe2+氧化成Fe3+,其反应的离子方程式为:MnO2+2Fe2++4H+=2Fe3++2H2O+Mn2+;
故答案为:将Fe2+氧化成Fe3+; MnO2+2Fe2++4H+=2Fe3++2H2O+Mn2+;
c.溶液中不能引入新的杂质离子,溶液中含有锰离子和锌离子,可加入MnCO3或ZnCO3来消耗氢离子,调节pH值,又不引入新的杂质,
故答案为:MnCO3或ZnCO3;
(3)①阳极失电子发生氧化反应,所以电极反应式为MnO42--e-=MnO4-;故答案为:MnO42--e-=MnO4-;
②根据阳极区反应MnO42--e-=MnO4-,锰原子的物质的量不变,所以仍为1.0L×0.40mol/L=0.4mol,电解一段时间后,溶液中$\frac{n(K)}{n(Mn)}$为6:5,所以反应后n(K)=0.48mol,则阳极区的K+定向移动到阴极区的物质的量为0.4mol×2-0.48mol=0.32mol,所以阴极生成KOH的物质的质量为0.32mol×56g/mol=17.9 g,
故答案为:17.9 g;
(4)①根据Al(OH)3、Cu(OH)2的溶度积常数,在25℃下,向浓度均为0.1mol•L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,$\root{3}{\frac{1.1×1{0}^{-33}}{0.1}}$<$\sqrt{\frac{2.2×1{0}^{-20}}{0.1}}$,加入相同的浓度的氨水,Al(OH)3最先析出,
故答案为:Al(OH)3;
②向沉淀反应器中加入过量的氨水,可使Mg2+、Al3+同时生成沉淀,故答案为:B;
③Fe3+完全沉淀时,c(OH-)3=$\frac{Ksp[Fe(OH)_{3}]}{c(F{e}^{3+})}$=$\frac{4.0×1{0}^{-38}}{1.0×1{0}^{-5}}$=4.0×10-33,Qc=c(Al3+)•(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有生成Al(OH)3沉淀,故答案为:不含有.
点评 本题考查了物质分离提纯方法和基本操作的综合应用、电解原理的应用、Ksp的有关计算,注意把握流程中发生的化学反应以及电解原理、Ksp的含义为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

| A. | 原子半径B<C<A | B. | 原子序数A>B>C | ||
| C. | 离子半径B2->C->A+ | D. | 原子的电子总数C<A<B |
| A. | Be2+中的质子和电子 | |
| B. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| C. | NaHC03中的阳离子和阴离子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
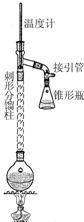
| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: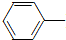 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$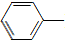 NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可以相同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| A. | 都可以保存在煤油中 | B. | 随电子层数增加,熔沸点逐渐降低 | ||
| C. | 都是银白色金属,质软,有延展性 | D. | 随电子层数增加,密度逐渐增大 |