题目内容
10.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
文字根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是离子交换膜电解槽.
(2)写出生产过程中X:Fe Y:HCl (填化学式).
(3)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是:防止CuCl水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体样品的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.
已知:CuCl+FeCl3═CuCl2+FeCl2
Fe2++Ce4+══Fe3++Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)氯碱工业的装置是离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(4)CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗涤可以减少CuCl的损失,生产过程中调节溶液的pH不能过大是防止其水解生成沉淀;
(5)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(6)①玻璃珠在物质溶解过程中可以加速固体的溶解;
③依据方程式中各反应物量之间的关系计算CuCl的纯度.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)氯碱工业的装置是离子交换膜电解槽,
故答案为:离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来,
故答案为:Fe;HCl;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解;
故答案为:减少CuCl的损失,防止CuCl水解;
(5)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失,
故答案为:防止CuCl的氧化和见光分解;
(6)①玻璃珠在物质溶解过程中可以加速固体的溶解,
故答案为:加速固体样品的溶解;
④根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为23.9×10-3L×0.1 mol•L-1×99.5g•mol-1/0.25g×100%=95%,
故答案为:95%;
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 浓硝酸见光或受热易分解,必须保存在棕色瓶中 | |
| B. | 浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 | |
| C. | 稀HNO3和活泼金属反应时主要得到氢气 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移的电子的物质的量为10mol |
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:
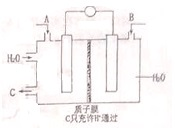
(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:
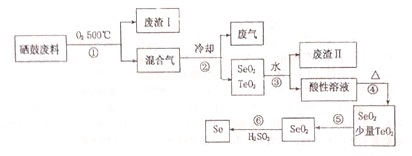
已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
| A. | 在离子化合物中也可能存在共价键 | |
| B. | 非金属元素之间的化学键不一定是共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含共价键的纯净物一定是共价化合物 |
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、K+、NH4+、Cl- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Cu2+、Br-、Cl- |
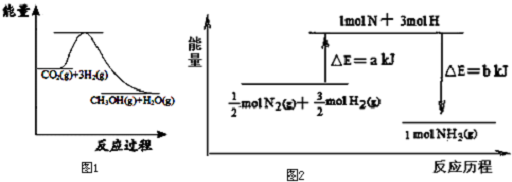
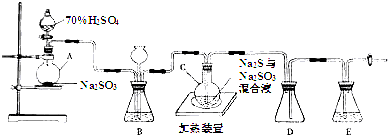
 .
.