题目内容
12.铝是一种重要的金属,在生产、生活中具有许多重要的用图,如图是从铝土矿中制备铝的工艺流程:
已知:
①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)溶解铝土矿时,其成分与NaOH溶液发生反应的离子方程式:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.
(2)滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;硅酸盐沉淀写成氧化物的形式是Na2O•Al2O3•2SiO2.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率.
(4)若该工厂用mkg铝土矿共制得nkgAl(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为$\frac{5100n}{27m}$%.
(5)若将铝用酸溶解,下列试剂中最好选用B(填编号).
A.浓硫酸 B.稀硫酸 C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是[AlF6]3-,配位数为6.
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物;
(3)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀;
(4)根据铝元素守恒由Al的质量计算出氧化铝的质量,再求出质量分数;
(5)根据Al的化学性质及不生成有毒气体来解答;
(6)中心离子和配体组成內界,其余部分为外界;配原子的数目即是配位数.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,离子反应分别为Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物,则Na2Al2Si2O8改写为氧化物为Na2O•Al2O3•2SiO2,
故答案为:Fe2O3、Na2Al2Si2O8;Na2O•Al2O3•2SiO2;
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,若选用盐酸,则生成的氢氧化铝会溶于过量的盐酸,所以第三步中选用二氧化碳作酸化剂,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)设铝土矿中氧化铝为xkg,
2Al~Al2O3
27×2 102
nkg xkg
则x=$\frac{102×nkg}{27×2}$=$\frac{51n}{27}$kg,
铝土矿中Al2O3的质量分数为$\frac{\frac{51n}{27}}{m}$×100%=$\frac{5100n}{27m}$%,
故答案为:$\frac{5100n}{27m}$%;
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)中心离子和配体组成內界,其余部分为外界,则Na3AlF6中Na+为外界,[AlF6]3-为內界;配原子的数目即是配位数,所以配位数为6,故答案为:[AlF6]3-;6.
点评 本题考查Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
(2)氧的原子结构示意图是
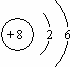 ;
;(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
| 编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg,0.1 | 3 mol•L-1硫酸10ml | 60 |
| B | Mg,0.1 | 3 mol•L-1盐酸10ml | 60 |
| C | Fe,0.1 | 3 mol•L-1盐酸10ml | 60 |
| D | Mg,0.1 | 3 mol•L-1硫酸10ml | 50 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
 ,而不是
,而不是 的事实是( )
的事实是( )| A. | 燃烧有浓烟 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 所在原子不在同一平面上 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
| A. | 白磷在260℃时转化为红磷 | B. | 石墨在高温下转化为金刚石 | ||
| C. | NaCl熔化 | D. | 氧化钙吸水 |
| A. | 当A、B都是金属,A的还原性一定比B强 | |
| B. | 当A、B都是非金属时,A的非金属性一定比B强 | |
| C. | 当A是金属时,B可能是金属,也可能是非金属 | |
| D. | 当A是非金属时,B可能是非金属,也可能是金属 |
| A. | X的原子半径大于Y | |
| B. | 若X为ⅠA族元素,则该化合物中含离子键 | |
| C. | 若X2Y的焰色为黄色,则它的电子式是 | |
| D. | 若每个X2Y分子中含有10个电子,则Y是第3周期元素 |