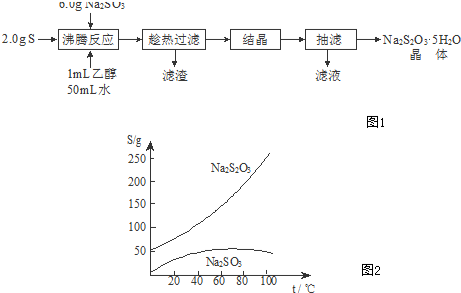
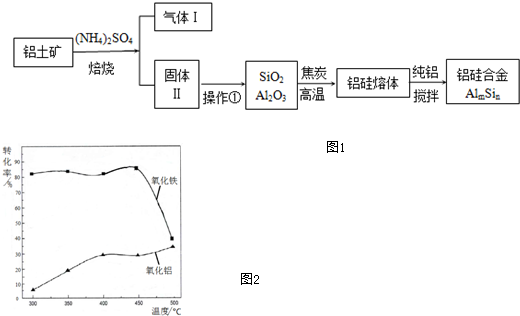
题目内容
14.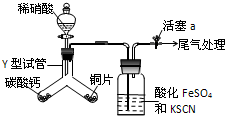 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.已知:FeSO4+NO→[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
(2)实验前需检验装置的气密性,简述操作关闭活塞a和分液漏斗活塞,向分液漏斗中加水,打开分液漏斗活塞,水滴入圆底烧瓶一会儿后不再滴入,则装置气密性良好.
(3)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;铜片和稀硝酸反应的化学方程式为3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O.
(4)洗气瓶中加入KSCN溶液的目的及原理是检验有无NO2产生,若有NO2,则NO2与水反应生成硝酸,硝酸将Fe2+氧化为Fe3+,Fe3+与SCN-反应溶液呈血红色,若无二氧化氮则无血红色;本实验只观察到洗气瓶中出现了棕色,写出尾气处理的化学方程式2NO+O2+2NaOH→NaNO2+NaNO3+H2O.
分析 (2)根据压强差进行装置气密性的检验;
(3)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;在常温下,铜片和稀硝酸反应生成硝酸铜、一氧化氮和水;
(4)本实验生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;用NaOH吸收尾气.
解答 解:(2)根据压强差进行装置气密性的检验,具体方法为:关闭活塞a和分液漏斗活塞,向分液漏斗中加水,打开分液漏斗活塞,水滴入圆底烧瓶一会儿后不再滴入,则装置气密性良好;
故答案为:关闭活塞a和分液漏斗活塞,向分液漏斗中加水,打开分液漏斗活塞,水滴入圆底烧瓶一会儿后不再滴入,则装置气密性良好;
(3)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;在常温下,铜片和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为3Cu+8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O;
故答案为:利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;3Cu+8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O;
(4)本实验生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;若无二氧化氮则无血红色;常用碱液吸收NO尾气,方程式为2NO+O2+2NaOH→NaNO2+NaNO3+H2O;
故答案为:检验有无NO2产生,若有NO2,则NO2与水反应生成硝酸,硝酸将Fe2+氧化为Fe3+,Fe3+与SCN-反应溶液呈血红色,若无二氧化氮则无血红色;2NO+O2+2NaOH→NaNO2+NaNO3+H2O.
点评 本题考查了铜和硝酸的反应实验,探究铜与稀硝酸反应的产物及影响反应速率的主要因素,对比、对照分析是解题的关键.

| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3CH2)2CHCH3 |
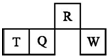 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应的水化物不能和强碱反应 |
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
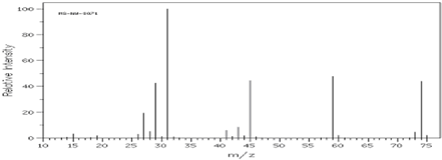
| A. | 74 | B. | 31 | C. | 59 | D. | 45 |