题目内容
18.下列事实不能作为实验判断依据的是( )| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
分析 A.元素的金属性越强,其单质与水或酸反应越剧烈;
B.元素的非金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其单质与氢气化合越容易.
解答 解:A.元素的金属性越强,其单质与水或酸反应越剧烈,钠和镁分别与冷水反应,判断金属活动性强弱,钠反应比镁剧烈,所以可以据此判断金属性强弱,故A正确;
B.钠投入硫酸铜溶液中,先钠和水反应生成NaOH,NaOH再和硫酸铜发生复分解反应,铁能置换出硫酸铜中的铜,这两个实验都说明Cu的活泼性最弱,不能说明Fe、Na的活泼性强弱,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,酸性H2CO3<H2SO4,这两种酸都是其最高价氧化物的水化物,所以能判断非金属性强弱,故C正确;
D.元素的非金属性越强,其单质与氢气化合越容易,Br2与I2分别与足量的H2反应,根据其反应剧烈程度判断非金属性强弱,故D正确;
故选B.
点评 本题考查金属性、非金属性强弱判断,侧重考查学生分析判断及知识运用能力,熟悉非金属性、金属性强弱判断方法,注意非金属性、金属性强弱与得失电子多少无关,只与得失电子难易程度有关,为易错点.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
7.莽草酸可用于合成药物达菲,其结构简式(如图),下列关于莽草酸的说法正确的是( )
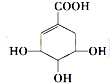

| A. | 分子式为C7H6O5 | |
| B. | 分子中含有的官能团有羟基、酯基、碳碳双键 | |
| C. | 可发生加成反应、取代反应、氧化反应、还原反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+,1mol达菲可与4mol Na反应生成2 mol H2 |
8.如图为香芹酮分子的结构,下列有关叙述正确的是( )


| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
6.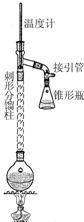 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
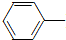 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$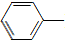 NHCOCH3+H2O
NHCOCH3+H2O
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
实验步骤如下:
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$ NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
13.研究NO2、SO2、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
①T1℃时,该反应的平衡常数K=0.56(保留两位小数).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.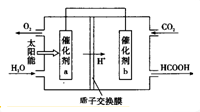 3×10-8mol•L-1)
3×10-8mol•L-1)
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.
 3×10-8mol•L-1)
3×10-8mol•L-1)(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
3.下列说法中正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可以相同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
7.已知丙烷的二氯代物有四种同分异构体,则其六氯代物的同分异构体数目有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 .
.