17.下列有关酸雨的说法正确的是( )
| A. | 酸雨就是指pH<7的雨水 | |
| B. | 工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 | |
| C. | 酸雨是因为雨水中含有CO2 | |
| D. | 酸雨没有危害,所以不必担心,也不必想办法治理 |
15.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)A组属于原子晶体,其熔化时克服的粒子间的作用力是化学键.
(2)B组晶体共同的物理性质是②③④(填序号).
①硬度大 ②导电性 ③导热性 ④延展性
(3)D组晶体可能具有的性质是②④(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高.
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1710 | Rb:39 | HI:-51 | CsCl:645 |
(1)A组属于原子晶体,其熔化时克服的粒子间的作用力是化学键.
(2)B组晶体共同的物理性质是②③④(填序号).
①硬度大 ②导电性 ③导热性 ④延展性
(3)D组晶体可能具有的性质是②④(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(4)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因解释为:都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高.
13.据报道,在40GPa高压下,用激光器加热到1800K,科学家已成功合成出CO2原子晶体,下列有关这种CO2晶体推断正确的是( )
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
12.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体.它的分子是三角锥形,以下关于PH3的叙述正确的是( )
| A. | PH3是非极性分子,难溶于水 | |
| B. | PH3的熔沸点高于NH3,极易被液化 | |
| C. | PH3稳定性弱于NH3,是因为NH3分子间还存在氢键 | |
| D. | PH3分子中有未成键的孤对电子 |
11.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
10.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
9.下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 原子晶体中的相邻原子间只存在非极性共价键 |
8.下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为 .
.
(2)写出②的氢化物的电子式: ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
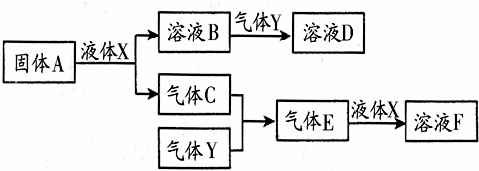
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
0 167716 167724 167730 167734 167740 167742 167746 167752 167754 167760 167766 167770 167772 167776 167782 167784 167790 167794 167796 167800 167802 167806 167808 167810 167811 167812 167814 167815 167816 167818 167820 167824 167826 167830 167832 167836 167842 167844 167850 167854 167856 167860 167866 167872 167874 167880 167884 167886 167892 167896 167902 167910 203614
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.

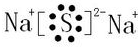 .
.