题目内容
17.下列有关酸雨的说法正确的是( )| A. | 酸雨就是指pH<7的雨水 | |
| B. | 工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 | |
| C. | 酸雨是因为雨水中含有CO2 | |
| D. | 酸雨没有危害,所以不必担心,也不必想办法治理 |
分析 A.通常情况下正常雨水因溶解二氧化碳而导致雨水pH约为5.6,当小于5.6时,为酸雨;
B.根据造成酸雨的主要成因进行判断;
C.导致酸雨的主要原因是二氧化硫和氮氧化物的排放;
D.酸雨危害很大,能够使土壤酸化,腐蚀建筑物等,所以必须对酸雨进行治理.
解答 解:A.正常雨水的pH为5.6,酸雨呈酸性,其pH<5.6,故A错误;
B.工业上大量燃烧含有硫燃料和以含硫矿石为原料冶炼金属的过程中都会产生二氧化硫气体,导致形成硫酸型酸雨,故B正确;
C.形成酸雨的主要物质是二氧化硫和氮氧化物,形成酸雨的气体不是二氧化碳,故C错误;
D.酸雨能造成土壤酸化,对农业造成危害,酸性还能够腐蚀建筑物,所以酸雨有害无利,必须进行治理,故D错误;
故选B.
点评 本题考查了酸雨的形成及其危害,题目难度不大,注意掌握酸雨的成因、危害及治理方法,可以依据已有的知识进行解答,要求同学们在平时的学习中加强基础知识的储备,以便灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A. | 该晶体类型是原子晶体 | |
| B. | 晶体的空间最小环共有6个原子构成 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
8.下列关于物质性质变化的比较中正确的( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH3
④还原性:F->Cl->Br-.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH3
④还原性:F->Cl->Br-.
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
5.下列各组所有的元素组合,既可以构成离子晶体,又可以构成分子晶体的是( )
| A. | S.O.K | B. | Na.C.O | C. | H.O.S | D. | H.N.O |
12.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体.它的分子是三角锥形,以下关于PH3的叙述正确的是( )
| A. | PH3是非极性分子,难溶于水 | |
| B. | PH3的熔沸点高于NH3,极易被液化 | |
| C. | PH3稳定性弱于NH3,是因为NH3分子间还存在氢键 | |
| D. | PH3分子中有未成键的孤对电子 |
9.苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实可以作为证据的是( )
①苯不能使溴的CCl4溶液褪色;②苯不能使酸性高锰酸钾溶液褪色;③苯在一定条件下既能发生取代反应,又能发生加成反应;④经测定,邻二甲苯只有一种结构;⑤苯的一氯代物只有一种.
①苯不能使溴的CCl4溶液褪色;②苯不能使酸性高锰酸钾溶液褪色;③苯在一定条件下既能发生取代反应,又能发生加成反应;④经测定,邻二甲苯只有一种结构;⑤苯的一氯代物只有一种.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②④ | D. | ①②③④ |
6.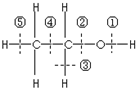 乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )
乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )
 乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )
乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的( )| A. | 乙烯分子为平面结构 | |
| B. | 乙烯可用作植物生长的调节剂 | |
| C. | 乙醇在铜催化下和氧气反应键①和③断裂 | |
| D. | 乙醇和乙酸、浓硫酸共热时键②断裂 |
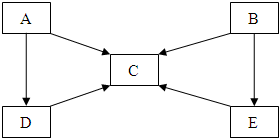 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D、E在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D、E在常温下都是气体,B为红棕色.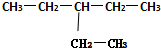 系统命名法:3-乙基戊烷
系统命名法:3-乙基戊烷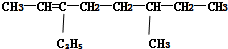 系统命名法:6-甲基-3-乙基-2-辛烯
系统命名法:6-甲基-3-乙基-2-辛烯