题目内容
8.下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
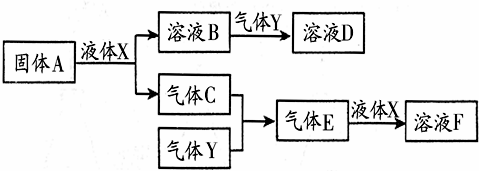
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Na、Mg、Al、Si、P、S元素,
Ⅰ(1)根据元素周期律,同周期从左向右元素非金属性逐渐增加,同主族从上向下元素金属性逐渐增加,所以在上述元素中,非金属性最强的元素是F,其离子带一个单位的负电荷;
(2)②的氢化物为氨气,溶液呈碱性,与少量的氯化铝反应生氢氧化铝;
(3)元素金属性越强,最高价氧化物对应的水化物中碱性越强,所以在上述元素对应的物质中,氢氧化钠的碱性最强,⑦的最高价氧化物对应的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠,据此写离子方程式;
(4)由③⑤⑩三种元素组成、且暴露空气中易变质,说明有还原性,则该物质为亚硫酸钠,能被氧化成硫酸钠;
Ⅱ由上述部分元素组成的物质,A是一种淡黄色固体,可作供氧剂,则A为过氧化钠,X是一种氢化物,常温下为液体,则X为水,则B为氢氧化钠,C为氧气,气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨,且能与B反应,则Y为二氧化硫,生成D为亚硫酸钠,氧气与二氧化硫反应生成E为三氧化硫,三氧化硫与水反应生成F为硫酸,据此答题.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、N、O、F、Na、Mg、Al、Si、P、S元素,
Ⅰ(1)根据元素周期律,同周期从左向右元素非金属性逐渐增加,同主族从上向下元素金属性逐渐增加,所以在上述元素中,非金属性最强的元素是F,其离子带一个单位的负电荷,离子结构示意图为 ,
,
故答案为:F; ;
;
(2)②的氢化物为氨气,氨气的电子式为 ,溶液呈碱性,与少量的氯化铝反应生氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
,溶液呈碱性,与少量的氯化铝反应生氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为: ;碱性;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
;碱性;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)元素金属性越强,最高价氧化物对应的水化物中碱性越强,所以在上述元素对应的物质中,氢氧化钠的碱性最强,化学式为NaOH,⑦的最高价氧化物对应的水化物为氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:NaOH;Al(OH)3+OH-=AlO2-+2H2O;
(4)由③⑤⑩三种元素组成、且暴露空气中易变质,说明有还原性,则该物质为亚硫酸钠,其化学式为Na2SO3,其中含有离子键、共价键,能被氧化成硫酸钠,反应的化学方程式为2Na2SO3+O2=2Na2SO4,
故答案为:Na2SO3;离子键、共价键;2Na2SO3+O2=2Na2SO4;
Ⅱ由上述部分元素组成的物质,A是一种淡黄色固体,可作供氧剂,则A为过氧化钠,X是一种氢化物,常温下为液体,则X为水,则B为氢氧化钠,C为氧气,气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨,且能与B反应,则Y为二氧化硫,生成D为亚硫酸钠,氧气与二氧化硫反应生成E为三氧化硫,三氧化硫与水反应生成F为硫酸,
(1)A为过氧化钠,A的晶体中存在的作用力有共价键、离子键,
故答案为:共价键、离子键;
(2)C为氧气,Y为二氧化硫,气体C与气体Y反应的化学方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)F为硫酸,在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,铜与浓硫酸反应生成二氧化硫,根据电子得失守恒可知,每产生1mol二氧化硫,会转移2mol电子,当产生二氧化硫的体积为11.2L(标况下),即为0.5mol时,反应过程中转移的电子数为NA 或6.02×1023,
故答案为:NA 或6.02×1023;
点评 本题考查了元素周期表和元素周期律的综合应用,涉及物质的相互转化、离子方程式、元素周期律、氧化还原反应的计算等知识点,元素推断及物质的推断是解题的关键,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 2-乙基戊烷 | B. | 3,4-二甲基己烷 | C. | 1,5-二甲基苯 | D. | 3,4-二甲基戊烷 |
C(石墨)+02(g)=C02(g),燃烧l mol C(石墨)放热393.51kJ.
C(金刚石)+02(g)=C02(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的正确结论是( )
| A. | 金刚石比石墨更稳定 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转变为石墨是物理变化 | D. | 石墨的能量比金刚石低 |
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 稀盐酸 |
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定条件下,CO2分子晶体转化为原子晶体是物理变化 |
| A. | 原子半径B<C<A | B. | 原子序数A>B>C | ||
| C. | 离子半径B2->C->A+ | D. | 原子的电子总数C<A<B |
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 同周期第IA族元素与第ⅦA族元素形成的是离子化合物 | |
| C. | 硫化氢的沸点比水的沸点高 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
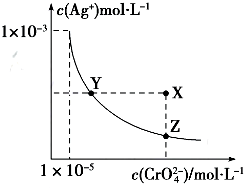
| A. | t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃时,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃时,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
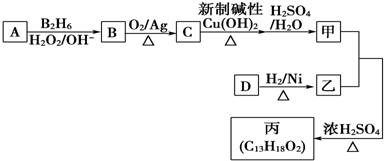
 ;
; ;
;