题目内容
16.有W、X、Y、Z四种原子序数依次增大的元素.已知:①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z的3d轨道上有电子,可与Y组成化合物ZY2和ZY3
请回答:
(1)W是Na,X是S,Y是Cl.(填元素符号)
(2)Z元素在元素周期表中的位置是第四周期VIII族,Z3+的核外电子排布式为:1s22s22p63s23p63d5.
(3)W2X的电子式为
 .
.
分析 有W、X、Y、Z四种原子序数依次增大的元素.已知:①W与X或Y形成的化合物的焰色反应均呈黄色,则W为Na元素;②X原子次外层电子数为核外电子总数的一半,原子序数大于Na元素,其核外电子数为8×2=16,则X为S元素;③X离子、Y离子均与Y的气态氢化物具有相同电子数,核外电子数为18,则Y为Cl元素;④Z的3d轨道上有电子,Z可与Cl组成常见化合物ZCl2和ZCl3,则Z为Fe元素,据此解答.
解答 解:有W、X、Y、Z四种原子序数依次增大的元素.已知:①W与X或Y形成的化合物的焰色反应均呈黄色,则W为Na元素;②X原子次外层电子数为核外电子总数的一半,原子序数大于Na元素,其核外电子数为8×2=16,则X为S元素;③X离子、Y离子均与Y的气态氢化物具有相同电子数,核外电子数为18,则Y为Cl元素;④Z的3d轨道上有电子,Z可与Cl组成常见化合物ZCl2和ZCl3,则Z为Fe元素,
(1)根据上面的分析可知,W为Na,X为S,Y为Cl,故答案为:Na;S;Cl;
(2)Z为Fe元素,Z元素在元素周期表中的位置是第 四周期VIII族,Z3+的核外电子排布式为:1s22s22p63s23p63d5,
故答案为:四;VIII;1s22s22p63s23p63d5;
(3)W为Na,X为S,W2X的电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查结构性质位置关系应用,涉及元素周期表、核外电子排布、电子式等,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
7.某烃的结构简式为CH3-CH2-CH=C(C2H5)-C≡CH,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
| A. | 4、3、6 | B. | 4、3、5 | C. | 2、5、4 | D. | 4、6、4 |
4.确定某溶液中含有SO42-,下列方案中正确的是( )
| A. | 先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解 | |
| B. | 先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀 | |
| C. | 先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀 |
11.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
1.下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
(1)单质的化学性质最不活沷的元素是Ne;
(2)氧的原子结构示意图是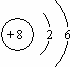 ;
;
(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
(2)氧的原子结构示意图是
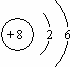 ;
;(3)形成化合物种类最多的元素是C;
(4)HF和H2O中,热稳定性较强的是HF;
(5)N和P中,原子半径较小的是N;
(6)常温下,会在浓硫酸中发生钝化的金属是Al;
(7)元素最高价氧化物对应水化物中,碱性最强的是NaOH(填化学式),酸性最强的是HClO4(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2.
8.下列有机物命名正确的是( )
| A. | 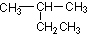 2-乙基丙烷 2-乙基丙烷 | B. | 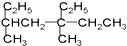 3,5-二甲基-3-乙基庚烷 3,5-二甲基-3-乙基庚烷 | ||
| C. | 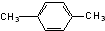 间二甲苯 间二甲苯 | D. | 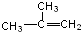 2-甲基-2-丙烯 2-甲基-2-丙烯 |
5.锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是2Zn+O2=2ZnO.下列有关它的说法正确的是( )
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电解质溶液是酸性溶液 | |
| C. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| D. | 负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |
7.下列各选项能说明分子式为C4H6的某烃是 ,而不是
,而不是 的事实是( )
的事实是( )
 ,而不是
,而不是 的事实是( )
的事实是( )| A. | 燃烧有浓烟 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 所在原子不在同一平面上 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |