6.二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上常采用甲醇气相脱水法来获取.其反应方程式为:
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式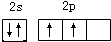 ;
;
写出甲醇分子中官能团的电子式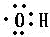 .
.
(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
①若要提高CH3OH的平衡转化率,可以采取的措施是ad(选填编号).
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式
 ;
;写出甲醇分子中官能团的电子式
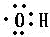 .
.(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
5.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
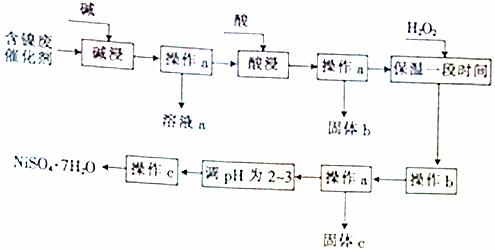
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
4.氨是重要的化工原料,可以制尿素等多种产品.
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.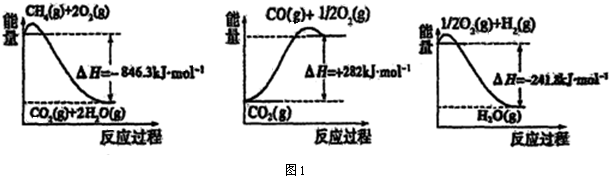
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)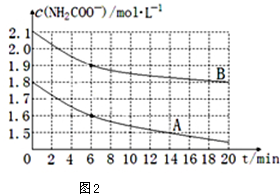
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)

3.下列说法错误的是( )
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| C. | 煤经过气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液 |
2.关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
1.下列各组物质中化学键的类型相同的是( )
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
19.下列有关反应速率的说法正确的是( )
| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
18.下列各项中表达正确的是( )
0 167707 167715 167721 167725 167731 167733 167737 167743 167745 167751 167757 167761 167763 167767 167773 167775 167781 167785 167787 167791 167793 167797 167799 167801 167802 167803 167805 167806 167807 167809 167811 167815 167817 167821 167823 167827 167833 167835 167841 167845 167847 167851 167857 167863 167865 167871 167875 167877 167883 167887 167893 167901 203614
| A. | F-的结构示意图: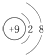 | B. | CH4分子的比例模型: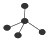 | ||
| C. | CCl4的电子式: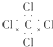 | D. | 乙烯的结构简式:CH2CH2 |
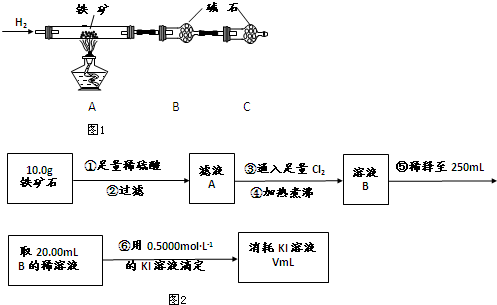
 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.