题目内容
5.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).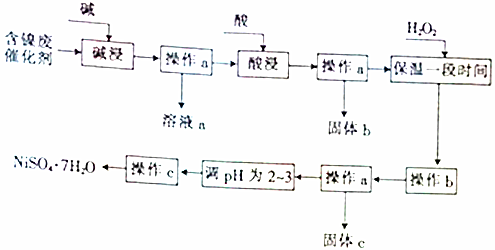
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
分析 由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).碱浸过滤得到固体加入酸浸过滤加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液PH2-3防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体;
(1)依据流程图分析判断,操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;
(2)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强酸强碱反应溶解得到溶液含有偏铝酸盐;
(3)依据最后制备NiSO4•7H2O,防止引入其他杂志离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子和镍离子,过滤后得到溶液为硫酸亚铁和硫酸镍溶液;
(4)依据氢氧化物沉淀的PH分析判断,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液;
(5)①过滤a得到滤液a为偏铝酸钠溶液,和过量盐酸反应生成氯化铝;
②根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式.
解答 解:(1)操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO4•7H2O;,操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为过滤装置中的漏斗和蒸发浓缩溶液需要的蒸发皿,
故答案为:漏斗、蒸发皿;
(2)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O;
(3))“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4•7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,
故答案为:H2SO4;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2-7.1间,故答案为:3.2-7.1;
(5)①过滤a得到滤液a为偏铝酸钠溶液,和过量盐酸反应生成氯化铝,反应的离子方程式为:AlO2-+4H+=Al3++2H2O,故答案为:AlO2-+4H+=Al3++2H2O;
②向1.0mo!•L-1 AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液,根据题意结合原子守恒、电荷守恒可得生成[AlO4Al12(OH)24(H2O)12]2+,反应的离子方程式为:13Al3++OH-+H2O=[AlO4Al12(OH)24(H2O)12]7+,
故答案为:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
点评 本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,铝及其化合物性质分析判断,题目难度中等.

| A. | 2-戊烯的同分异构体数目为五种 | |
| B. | 丙烯与HCl加成产物是1-氯丙烷 | |
| C. | 组成为CnH2n的烃,当n=4时,才具有同分异构体 | |
| D. | 能使溴水或酸性KMnO4溶液褪色的C4H8的物质可能有三种 |
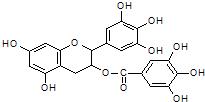 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )| A. | EGCG能与碳酸钠溶液反应放出二氧化碳 | |
| B. | EGCG遇FeCl3溶液能发生显色反应 | |
| C. | 1molEGCG最多可与含10mol NaOH的溶液完全作用 | |
| D. | EGCG在空气中易氧化 |
| A. | 仅在O2中 | B. | 仅在NO2中 | C. | 仅在O2和NO2中 | D. | 平衡体系中 |
| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式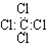 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
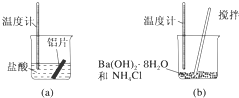 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.
 )与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )
)与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )

 回答下列问题:
回答下列问题: