题目内容
20. (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是放热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该低于其生成物的总能量.
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):
能设计成原电池的反应是②④.
分析 (1)探究化学反应中的能量变化时,温度升高,则反应放热;温度降低则反应吸热;吸热反应反应物总能量低于生成物,据此分析;
(2)能设计成原电池的反应必须是自发进行的放热的氧化还原反应,据此分析解答.
解答 解:(1)通过实验测出,反应前后a烧杯中的温度升高,b烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,b是吸热反应,反应物总能量低于生成物,故答案为:放;低于;
(2)①氢氧化钠与硫酸反应,该反应不是氧化还原反应,所以不能设计成原电池,故错误;
②一氧化碳与氧气反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确;
③八水合氢氧化钡与氯化铵反应,该反应是吸热反应,所以不能设计成原电池,故错误;
④金属铜与硝酸银反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确,
故答案为:②④.
点评 本题考查学生根据实验现象判断放热与吸热反应、原电池原理,注意放热反应反应物总能量高于生成物,断键吸收能量少于成键放出能量,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.对于反应:A+B?C,下列条件的改变一定能使化学反应速率加快的是( )
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
11.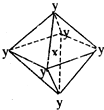 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )
在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )
 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )
在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )| A. | NaCl | B. | CsCl | C. | CO2 | D. | SiO2 |
8.下列有机物分子中,所有原子一定在同一平面内的是( )
| A. | 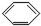 | B. | 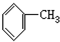 | C. | 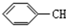 =CH2 =CH2 | D. | CH3CH=CH2 |
15.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用.下列说法正确的是( )
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是离子化合物 | D. | 二氧化氯分子中氯为-1价 |
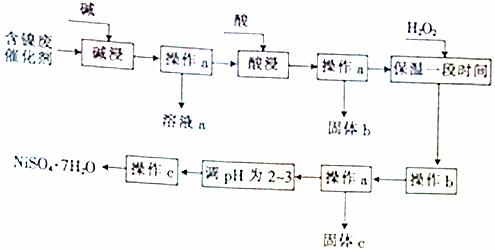
5.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
10.下列关于化学反应速率的说法错误的是( )
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
 .该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
.该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.