题目内容
1.下列各组物质中化学键的类型相同的是( )| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
分析 化学键分为离子键和共价键,离子键为阴阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键.
解答 解:A、CaCl2、MgCl2、Na2O都为离子化合物,只含有离子键,化学键类型相同,故A正确;
B、H2O和CO2只含有共价键,Na2O存在离子键,化学键类型不相同,故B错误;
C、CaCl2、NaOH为离子化合物,含有离子键,H2SO4为共价化合物,只含有共价键,化学键类型不相同,故C错误;
D、H2O、CO2只含有共价键,NH4Cl存在离子键和共价键,化学键类型不相同,故D错误;
故选A.
点评 本题考查化学键类型的判断,题目难度不大,注意共价键和离子键的区别.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
11.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时B的浓度是原来的35%,则( )
| A. | 物质A的转化率大了 | B. | a<b | ||
| C. | 物质B的质量分数减小了 | D. | 平衡向正反应方向移动了 |
12.下列说法正确的是( )
| A. | 在水中能电离出离子的化合物一定是离子化合物 | |
| B. | CO2分子中含极性键,且溶于水能导电,所以CO2是电解质 | |
| C. | Ca(OH)2微溶于水,所以是弱电解质 | |
| D. | CH3COOH在水中只能部分电离,所以是弱电解质 |
9.乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
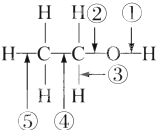

| A. | 和金属钠反应时①键断裂 | |
| B. | 在铜催化及加热条件下与O2反应时断裂①键和③键 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
16.下列叙述错误的是( )
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相同 | |
| C. | 14C和14N的质量数相同,它们的中子数不等 | |
| D. | 6Li和7Li电子数相同,中子数也相同 |
6.二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上常采用甲醇气相脱水法来获取.其反应方程式为:
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式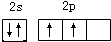 ;
;
写出甲醇分子中官能团的电子式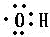 .
.
(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
①若要提高CH3OH的平衡转化率,可以采取的措施是ad(选填编号).
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式
 ;
;写出甲醇分子中官能团的电子式
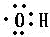 .
.(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
13.25℃时,用浓度为0.100mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.100mol/L的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断正确的是( )
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
10.将两支盛有液态苯的试管分别插入95℃的水和4℃的水中,分别发现苯分别沸腾和凝固,以上事实说明( )
| A. | 苯的熔点比水的低、沸点比水的高 | B. | 苯的熔点比水的高、沸点比水的低 | ||
| C. | 苯的熔点、沸点都比水的高 | D. | 苯的熔点、沸点都比水的低 |
11.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丁烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |