题目内容
19.下列有关反应速率的说法正确的是( )| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
分析 对于化学反应,增大浓度、升高温度、加入催化剂以及增大固体的表面积可增大反应速率,结合选项中所给信息解答该题.
解答 解:A.铁与浓硫酸反应在铁表面形成一层致密的氧化物保护膜,防止浓硫酸继续和铁反应,所以浓硫酸不能加快反应速率,故A错误.
B.加入氯化钠溶液,溶液体积增大,氢离子浓度减小,则反应速率减小,故B错误;
C.升高温度对反应速率的影响是增多单位体积内活化分子数增多,正逆反应速率都增大,故C错误;
B.减小压强,活化分子百分数不变,但是压强减小,反应速率减小,故D正确;
故选:D.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
9.对于化学反应3W(g)+2X(g)═4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
| A. | v(X)=v(Y) | B. | 3v(W)=2v(X) | C. | 2v(X)=v(Y) | D. | 2v(X)=3v(Z) |
10.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X>Y | |
| B. | Y单质与Z的最高价氧化物对应的水化物反应可制备氢气 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
14.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | K+HCO3-NO3-ClO- | B. | Na+SO32-NH4+Ba2+ | ||
| C. | Ba2+ HS-Cl-SO42- | D. | AlO2-CO32-Cl-Na+ |
4.氨是重要的化工原料,可以制尿素等多种产品.
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.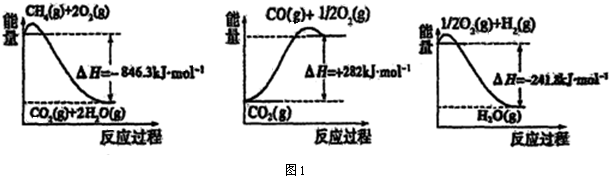
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)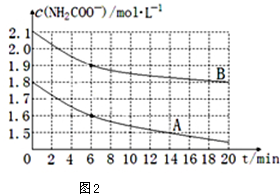
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)

11.现有某无色溶液,只可能含有下表中的几种离子.
为分析其组成,现进行如下实验:
①取 l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到 0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| 阳离子 | NH4+、Mg2+、K+、Al3+ |
| 阴离子 | HCO3-、MnO4-、SO42-、Cl- |
①取 l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到 0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有 Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有 K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
8.据某科学杂志报道,国外发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构.下列叙述不正确的是( )
| A. | 该物质的熔点不会很高、硬度不会很大 | |
| B. | 该物质形成的晶体属于分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | 该物质的相对分子质量为2400 |
9.下列各组元素性质或原子结构递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |