题目内容
4.氨是重要的化工原料,可以制尿素等多种产品.(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.
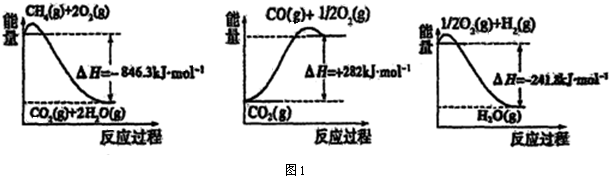
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
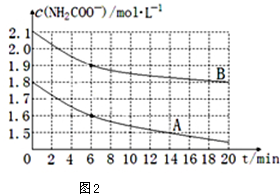
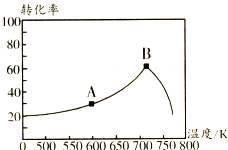
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
分析 (1)依据图象分析各个反应过程中能量变化情况,写出热化学方程式,依据盖斯定律计算CH4(g)与H2O(g)反应生成CO(g)和H2(g)的反应热,据此写出热化学方程式;
(2)依据平衡移动方向分析判断需要的条件,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理;
(3)依据化学方程式和平衡常数概念写出表达式,注意尿素是固体;根据化学平衡三段式列式计算平衡浓度,计算平衡常数;
(4)根据图象中曲线的斜率比较化学反应速率,判断A、B温度的大小;
(5)①依据弱电解质电离平衡常数比较弱电解质强弱,盐类水解原理分析判断溶液酸碱性;
②依据溶液中离子性质,电荷守恒、物料守恒、离子浓度大小比较的方法分析选择.
解答 解:(1)由图象分析反应过程都是能量降低的过程,说明反应是放热反应;反应的热化学方程式分别为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由盖斯定律①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压;
故答案为:B;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).依据化学方程式和平衡常数概念写出平衡常数K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度0.02mol/L×50%=0.01mol/mol;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$=$\frac{0.01}{0.0{2}^{2}×0.01}$=2500L2•mol-2,
故答案为:2500 L2•mol-2;
(4)图象中纵坐标为c(NH2COO-),横坐标为时间,所以斜率为NH2COO-的反应速率,根据图象可知A曲线的斜率大,其反应速率大,说明温度高,
故答案为:A;A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高;
(5)①分析电离平衡常数可知电离程度,NH3•H2O>H2CO3>HCO3-,对应盐水解程度NH4+<HCO3-<CO32-,常温下0.1mol•L-1的(NH4)2CO3溶液呈碱性,由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;
故答案为:碱,由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性;
②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O),故A正确;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B错误;
C.依据溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1 ,故C正确;
D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正确;
故答案为:B.
点评 本题考查了热化学方程式书写方法,化学平衡影响因素分析,电解质溶液中离子浓度关系的应用判断,掌握基础是关键,题目难度较大.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值 | |
| B. | 鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水 | |
| C. | 苯中的少量苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| D. | 苯酚的酸性很弱,但可以和Na2CO3反应 |
| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
| A. | 随着反应的进行,CO32-在不断消耗 | |
| B. | 该电池的正极的反应式为:4OH-+4e-=O2+2H2O | |
| C. | 放电时CO32-向正极移动 | |
| D. | 该电池负极的反应为:H2+CO32--2e-=H2O+CO2 |
| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将淀粉与稀H2SO4混合后加热,3min~4min后,直接向反应后的混合物中加入银氨溶液,检验葡萄糖的存在(已知淀粉在酸性条件下能水解成葡萄糖,葡萄糖含醛基) | |
| C. | 向试管中加入5mL溴水、2mL苯和0.5g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
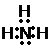 、E的结构式H-O-H、F的化学式为Fe3O4.
、E的结构式H-O-H、F的化学式为Fe3O4.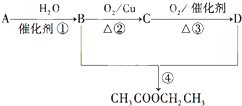 已知:
已知: .
. 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息: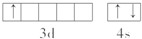 .该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.
.该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.