19.下列关于电解质溶液的叙述正确的是( )
| A. | pH均为4的H2SO4、NH4Cl溶液中,水的电离程度相同 | |
| B. | 等pH的NaOH溶液与NH3•H2O 稀释后pH的变化如右图所示,则曲线I表示的是NaOH溶液的稀释 | |
| C. | 1mol/LNa2CO3溶液中存在:c(Na+)=2c(CO32- )+2c(HCO3-) | |
| D. | 向某温度的氨水中通入盐酸,则氨水的电离常数增大 |
18.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 当溶液中的氨基酸主要以两性离子的形态存在时,它在水中的溶解度最小,可以形成晶体析出.不同的氨基酸出现这种情况的pH各不相同,利用这一差别,可以通过调节溶液pH分离某些氨基酸 | |
| C. | 有机硅聚醚 (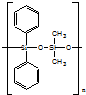 )可由单体 )可由单体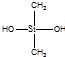 和 和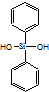 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、二甲醚完全燃烧时的耗氧量依次递增 |
17.下列说法不正确的是( )
| A. | 李比希基团理论、逆合成分析理论、范特霍夫对有机化合物结构的三维认识都为有机化学的发展作出贡献 | |
| B. | 同位素示踪法、核磁共振法、红外光谱法、质谱法等是研究有机反应机理的重要方法 | |
| C. | 洗气、蒸馏、萃取、分液、结晶等是有机化合物的分离与提纯的常见方法 | |
| D. | 德国化学家维勒在制备氰酸铵时得到了尿素,打破了无机物和有机物的界限 |
14.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中的空间构型为正四面体形 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
11. 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
(1)该反应的化学平衡常数K与温度T的关系如下
其中K1> K2 (填“>”“<”或“=”)
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
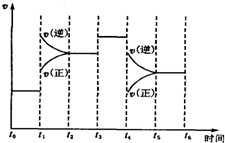
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
0 167671 167679 167685 167689 167695 167697 167701 167707 167709 167715 167721 167725 167727 167731 167737 167739 167745 167749 167751 167755 167757 167761 167763 167765 167766 167767 167769 167770 167771 167773 167775 167779 167781 167785 167787 167791 167797 167799 167805 167809 167811 167815 167821 167827 167829 167835 167839 167841 167847 167851 167857 167865 203614
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
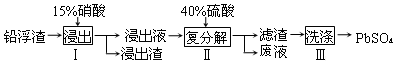
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形. ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.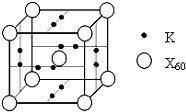 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题: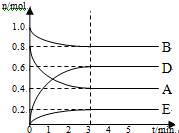 某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.
某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.