题目内容
12.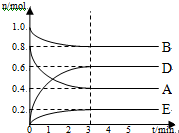 某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.
某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.请回答下列问题:
(1)写出该反应的方程式:2A(g)+B(g)?3D(g)+E(s)
(2)按图a所示,反应开始至达到平衡时,用D表示该反应速率为:0.1mol/(L•min)
(3)该反应中反应物总能量比生成物总能量大,则该反应为放热反应.
(4)解释3min后各组分物质的量不变的原因加入催化剂或改变压强.
分析 (1)图象分析可知AB为反应物,DE为生成物,物质变化的物质的量之比等于化学方程式计量数之比,据此写出化学方程式;
(2)图象分析D物质的量增大了0.6mol,反应速率V=$\frac{△c}{△t}$计算;
(3)依据反应前后能量守恒分析判断反应的热量变化;
(4)反应前后气体物质的量不变,图象分析可知3min后各组分物质的量不变,改变的条件可能是加入催化剂或改变压强.
解答 解:(1)图象分析,各物质的物质的量变化为:n(A)=0.8mol-0.4mol=0.4mol,n(B)=1.0mol-0.8mol=0.2mol,n(D)为0.6mol,n(E)=0.2mol,则化学方程式计量数之比等于反应中物质的量之比:n(A):n(b):n(D):n(E)=0.4:0.2:0.6:0.2=2:1:3:1,得到化学方程式为:2A(g)+B(g)?3D(g)+E(s);
故答案为:2A(g)+B(g)?3D(g)+E(s);
(2)图象分析D物质的量增大了0.6mol,V(D)=$\frac{△c}{△t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),故答案为:0.1;
(3)该反应中反应物总能量比生成物总能量大,则该反应为放热反应,故答案为:放热;
(4)2A(g)+B(g)?3D(g)+E(s)反应前后气体物质的量不变,图象分析可知3min后各组分物质的量不变,改变的条件可能是加入催化剂或改变压强;
故答案为:加入催化剂或改变压强.
点评 本题考查了外界条件对化学平衡的影响,难度中等,注意温度对所有的化学平衡的影响,考查学生读图提取信息的能力、分析问题解决问题的能量以及计算能力,侧重于化学平衡有关知识的综合考查.

练习册系列答案
相关题目
9.下列不属于影响离子晶体结构的因素是 ( )
| A. | 晶体中阴、阳离子的半径比 | B. | 离子晶体的晶格能 | ||
| C. | 晶体中阴、阳离子的电荷比 | D. | 离子键的纯粹程度 |
7. 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
17.下列说法不正确的是( )
| A. | 李比希基团理论、逆合成分析理论、范特霍夫对有机化合物结构的三维认识都为有机化学的发展作出贡献 | |
| B. | 同位素示踪法、核磁共振法、红外光谱法、质谱法等是研究有机反应机理的重要方法 | |
| C. | 洗气、蒸馏、萃取、分液、结晶等是有机化合物的分离与提纯的常见方法 | |
| D. | 德国化学家维勒在制备氰酸铵时得到了尿素,打破了无机物和有机物的界限 |
1.如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)?2SO3(g);△H<0反应速率的变化情况(v′表示正反应速率,v″表示逆反应速率).下列说法中正确的是( )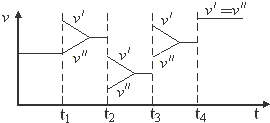

| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
2.黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则( )
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
 .
.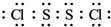 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.