��Ŀ����
18������˵������ȷ���ǣ�������| A�� | ij�������ķ���ʽΪC10H14��������ʹ��ˮ��ɫ������ʹ����KMnO4��Һ��ɫ���ҷ��ӽṹ��ֻ��һ���������������������3�� | |
| B�� | ����Һ�еİ�������Ҫ���������ӵ���̬����ʱ������ˮ�е��ܽ����С�������γɾ�����������ͬ�İ�����������������pH������ͬ��������һ��𣬿���ͨ��������ҺpH����ijЩ������ | |
| C�� | �л������ ��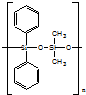 �����ɵ��� �����ɵ���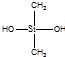 �� ��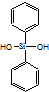 ���۶��� ���۶��� | |
| D�� | �������ļ״�����ȩ����������ȫȼ��ʱ�ĺ��������ε��� |
���� A����� ���뱽��������Cԭ���ϲ���Hԭ�ӣ�����ʹ���Ը��������Һ��ɫ��
���뱽��������Cԭ���ϲ���Hԭ�ӣ�����ʹ���Ը��������Һ��ɫ��
B����ͬ�İ�����ﵽ�ȵ���pH��ͬ���ɿ���pH�����ܽ�Ȳ�����룻
C��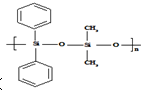 �к�Si-O-Si�ļ��ṹ��
�к�Si-O-Si�ļ��ṹ��
D���л���ȼ�շ�ӦΪCxHyOz+��x+$\frac{y}{4}$-$\frac{z}{2}$��O2$\stackrel{��ȼ}{��}$xCO2+$\frac{y}{2}$H2O�����n=$\frac{m}{M}$�������ĵ�����
��� �⣺A�����ķ���ʽ����2n-6��ͨʽ��������ʹ��ˮ��ɫ������ʹKMnO4������Һ��ɫ�����Ժ��б�������������֪���÷��Ӻ��ж������������ֻ�ж϶��������ͬ���칹�弴�ɣ����������̼��ͬ���칹���У� ������ͬϵ�����뱽��������Cԭ���ϱ��뺬��Hԭ�ӣ��ſɱ����Ը������������ʹ���Ը��������Һ��ɫ�����
������ͬϵ�����뱽��������Cԭ���ϱ��뺬��Hԭ�ӣ��ſɱ����Ը������������ʹ���Ը��������Һ��ɫ����� ���뱽��������Cԭ���ϲ���Hԭ�ӣ�����ʹ���Ը��������Һ��ɫ����ֻ��3�ַ��ϣ���A��ȷ��
���뱽��������Cԭ���ϲ���Hԭ�ӣ�����ʹ���Ը��������Һ��ɫ����ֻ��3�ַ��ϣ���A��ȷ��
B����ͬ�İ�����ﵽ�ȵ���pH��ͬ�����ڵȵ���ܽ����С���й��������������ͨ��������ҺpH����ijЩ�����ᣬ��B��ȷ��
C�� �к�Si-O-Si�ļ��ṹ����֪���л����ɵ���
�к�Si-O-Si�ļ��ṹ����֪���л����ɵ��� 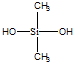 ��
�� ���۶��ɣ���C��ȷ��
���۶��ɣ���C��ȷ��
D���л���ȼ�շ�ӦΪCxHyOz+��x+$\frac{y}{4}$-$\frac{z}{2}$��O2$\stackrel{��ȼ}{��}$xCO2+$\frac{y}{2}$H2O���������ļ״�����ȩ��������ȫȼ��ʱ�ĺ������ֱ�Ϊ$\frac{m}{32}$����1+$\frac{4}{4}$-$\frac{1}{2}$��=$\frac{m}{21.3}$��$\frac{m}{30}$����1+$\frac{2}{4}$-$\frac{1}{2}$��=$\frac{m}{30}$��$\frac{m}{46}$����2+$\frac{6}{4}$-$\frac{1}{2}$��=$\frac{m}{15.3}$����֪��ȩ���ĵ��������٣���D����
��ѡD��
���� ���⿼����ۺϣ��漰�л���Ľṹ�����ʡ��߾��ﵥ���жϼ��л�ȼ�շ�Ӧ�ļ���ȣ�ע�ظ�Ƶ����Ŀ��飬�Ϻõ�ѵ��ѧ��������Ӧ����������Ŀ�ѶȲ���

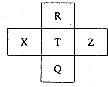 Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�����±���ʾ��RԪ��ԭ��������������������Ӳ�����3���������ж���ȷ���ǣ�������
Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�����±���ʾ��RԪ��ԭ��������������������Ӳ�����3���������ж���ȷ���ǣ�������| A�� | XԪ�ص�����������Ӧ��ˮ��������ǿ��TԪ�� | |
| B�� | ԭ�Ӱ뾶��R��T��Z | |
| C�� | Z�ĵ��ʿɴ�T����̬�⻯�����û���T�ĵ��� | |
| D�� | R��T��Q���������ͬ |
| A�� | ��ϵͳ���������л��� ��������2��2��4��5-�ļ�-3��3-���һ����� ��������2��2��4��5-�ļ�-3��3-���һ����� | |
| B�� | �����ױ������ױ���Ϊͬϵ�����ʹ���Ը��������Һ��ɫ | |
| C�� | �������ı�����Ȳ����ϩ�ͼ���ֱ��������г��ȼ�գ������ĵ����������������� | |
| D�� | 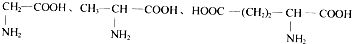 ���ְ�����֮����ˮ����������6�ֶ��� ���ְ�����֮����ˮ����������6�ֶ��� |
��ʵ��ԭ����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O
��ʵ�����ݼ���¼��
ʵ��1��2��3��4�����б���ҩƷ����ʵ�飬������ˮϡ����10mL�������ˮ�����߿�ʼ��Ӧ������ʵ��ͬ�������������¹۲���Һ��ɫ��ȥʱ�䣬����¼���£�
| ʵ���� | �����£��Թ��������Լ���������/mL | ��������Һ��ɫ������ɫ����ʱ��/min | ||
| 0.6 mol/L H2C2O4��Һ | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |
��1�������ϱ��е�ʵ�����ݣ����Եõ��Ľ���������������ͬʱ������KMnO4Ũ�ȷ�Ӧ��������
��2������ʵ��1�����ݼ��㣬��KMnO4��Ũ�ȱ仯��ʾ�ӷ�Ӧ��ʼ����ɫ��ɫ���ʱ��÷�Ӧ�ķ�Ӧ����Ϊ��
�ԣ�KMnO4��=1.5��10-2mol/��L•min����
��3����С��ͬѧ���ݾ��������n��Mn2+�� ��ʱ��仯���Ƶ�ʾ��ͼ����ͼ1��ʾ������ͬѧ�������е�ʵ�����Ϸ��֣���ʵ�������n��Mn2+�� ��ʱ��仯������Ӧ��ͼ2��ʾ����С��ͬѧ����ͼ2��ʾ��Ϣ������µļ��裬����������ʵ��̽����

�ٸ�С��ͬѧ����ļ������������е�MnSO4Ϊ�÷�Ӧ�Ĵ�������Mn2+�Ը÷�Ӧ�д����ã���
�����������С��ͬѧ���ʵ�鷽��������д���пհף�
| ʵ���� | �����£��Թ��������Լ���������/mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ��/min | ||
| 0.6 mol/L H2C2O4��Һ | 0.2 mol/L KMnO4��Һ | 3 mol/L ϡ���� | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
b������ʹˮ�ֽ����⣺2H2O$\frac{\underline{\;����\;}}{\;}$2H2��+O2��
c��̫������ֽ�ˮ���⣺2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{̫����}$2H2��+O2��
d����Ȼ�����⣺CH4+H2O$\frac{\underline{\;����\;}}{\;}$CO+3H2 ����˵����ȷ���ǣ�������
| A�� | ����d����Ϊ���ܵ�һ�ַ��� | |
| B�� | ����a��d�У�H2O�����еĹ��ۼ�ȫ������ | |
| C�� | H2O��H2O2�����Ļ�ѧ��������ȫ��ͬ | |
| D�� | H2O�ǹ��ۻ����CH4�����ӻ����� |
| A�� | I2���� | B�� | NaCl���������� | ||
| C�� | H2SO4����ˮ��������Һ | D�� | NaOH�����ۻ� |
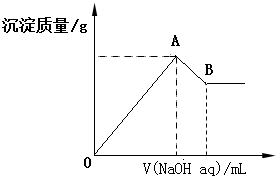
| A�� | x=$\frac{2a}{5-a}$ | |
| B�� | x��ȡֵ��Χ��0��x��$\frac{11}{32}$ | |
| C�� | A��������ֵ��x�����仯 | |
| D�� | ��B�������Ϊ200mLʱ��c��NaOH��=7.0mol/L |
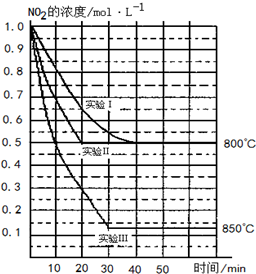 ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺
ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺