题目内容
11. 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.(1)该反应的化学平衡常数K与温度T的关系如下
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(2)合成氨在农业和国防中有很重要的意义,在实际生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD
A.用铁触媒加快化学反应速率
B.采用较高压强(20MPa~50MPa )
C.采用较高温度 (400℃~500℃)
D.将生成的氨液化并及时从体系中分离出来
(3)在某一温度下,向体积不变的容器中加入2molN2、8molH2及固体催化剂,平衡时,容器内气体压强为起始的80%,反应达到平衡时,N2的转化率是50%,此时反应放出的热量=92.2kJ(填“>”“<”或“=”)
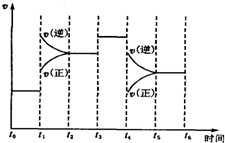
(4)在某段时间t0~t6中反应速率与时间的曲线图如下,则氨百分含量最高的时间段A
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(5)t1时刻改变的条件是,升高温度;t3时刻改变的条件是:加入催化剂;t4时刻改变的条件是减小压强.
分析 (1)该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
(2)勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用;
(3)温度、体积不变时,气体的物质的量之比等于其压强之比,平衡时,容器内气体压强为起始的80%,则平衡使混合气体物质的量=(2+8)mol×80%=8mol,气体物质的量减少(2+8)mol×(1-80%)=2mol,根据方程式知,参加反应的氮气物质的量=$\frac{1}{2}×2mol$=1mol,据此计算其转化率;
1mol氮气参加反应,放出的热量为92.2kJ;
(4)根据正逆反应速率相对大小判断反应方向,从而确定氨气百分含量;
(5)t1时刻,正逆反应速率都增大,且和原来平衡点不接触,改变的条件可能是升高温度或增大压强,但逆反应速率大于正反应速率,只能升高温度;
t3时刻,正逆反应速率都增大且相等,改变的条件只能是使用催化剂;
t4时刻,正逆反应速率都减小,且和原来平衡点不接触,可能是减小压强或降低温度,改变的条件时平衡逆向移动,只能是减小压强.
解答 解:(1)该反应的正反应是放热反应,升高温度平衡逆向移动,生成物浓度降低、反应物浓度增大,所以化学平衡常数减小,则K1>K2,故答案为:>;
(2)A.用铁触媒加快化学反应速率,是利用铁触媒做催化剂降低反应的活化能,加快反应速率,不改变化学平衡,不能用勒夏特列原理解释,故错误;
B.反应是气体体积减小的反应,加压平衡正向进行符合化学平衡移动原理,可以用勒夏特列原理解释,故正确;
C.合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,催化剂活性大,与勒沙特列原理不符,故错误;
D.将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,可以用勒夏特列原理解释,故正确;
故选BD;
(3)温度、体积不变时,气体的物质的量之比等于其压强之比,平衡时,容器内气体压强为起始的80%,则平衡使混合气体物质的量=(2+8)mol×80%=8mol,气体物质的量减少(2+8)mol×(1-80%)=2mol,根据方程式知,参加反应的氮气物质的量=$\frac{1}{2}×2mol$=1mol,氮气转化率=$\frac{1mol}{2mol}×100%$=50%;
根据方程式知,1mol氮气参加反应,放出的热量为92.2kJ,该反应中有1mol氮气参加反应,所以放出的热量为92.2kJ,
故答案为:50%;=;
(4)t0~t1时,正逆反应速率相等,平衡不移动;
t1~t2时,逆反应速率大于正反应速率,平衡向逆反应方向移动;
t2~t3时,正逆反应速率相等,平衡不移动;
t3~t4时,正逆反应速率相等,平衡不移动;
t5~t6时,逆反应速率大于正反应速率,平衡逆向移动,
所以氨气含量最大的是t0~t1时,
故选A;
(5)t1时刻,正逆反应速率都增大,且和原来平衡点不接触,改变的条件可能是升高温度或增大压强,但逆反应速率大于正反应速率,平衡逆向移动,所以只能升高温度;
t3时刻,正逆反应速率都增大且相等,平衡不移动,则改变的条件只能是使用催化剂;
t4时刻,正逆反应速率都减小,且和原来平衡点不接触,可能是减小压强或降低温度,改变的条件时平衡逆向移动,只能是减小压强,
故答案为:升高温度;加入催化剂;减小压强.
点评 本题考查化学平衡计算、反应速率与化学平衡图象、化学平衡移动原理等知识点,侧重考查分析计算判断能力,难点是根据反应速率相对大小判断改变条件及平衡移动方向,题目难度中等.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
| A. | 按系统命名法,有机物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 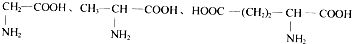 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
b.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
c.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
d.天然气制氢:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2 下列说法正确的是( )
| A. | 方法d是最为节能的一种方法 | |
| B. | 方法a~d中,H2O分子中的共价键全部断裂 | |
| C. | H2O、H2O2所含的化学键类型完全相同 | |
| D. | H2O是共价化合物,CH4是离子化合物 |
 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )| A. | 佳味备醇含有一个苯环,它是一种芳香族化合物 | |
| B. | 佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应 | |
| C. | 佳味备醇分子中至少有十二个原子在同一平面上 | |
| D. | 1mol佳味备醇分别与氢气、溴水反应时,最多消耗4molH2,4molBr2 |
| A. | 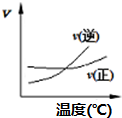 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 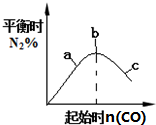 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. |  N2(g)+3H2(g)?2NH3(g)如图说明t秒时合成氨反应达到平衡 | |
| D. |  2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
 ②H20
②H20 ③O=C=O
③O=C=O ④CCl4
④CCl4 ⑤Fe2+Fe2+⑥N2
⑤Fe2+Fe2+⑥N2
 .
. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形. ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.