17.下列各组物质各自形成的晶体,都属于分子晶体的化合物的是( )
| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
16.下列有关物质结构与粒子间的作用方式的叙述中,正确的是( )
| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 分子晶体在熔化时,共价键没有被破坏 | |
| C. | 在晶体里有阳离子存在时,不一定有阴离子存在 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
14.下列粒子的空间构型不是正四面体的是( )
| A. | SiH4 | B. | CH3Cl | C. | P4 | D. | NH4+ |
11.下列做法中,不利于实现让金坛“天更蓝,水更清”目标的是( )
0 167555 167563 167569 167573 167579 167581 167585 167591 167593 167599 167605 167609 167611 167615 167621 167623 167629 167633 167635 167639 167641 167645 167647 167649 167650 167651 167653 167654 167655 167657 167659 167663 167665 167669 167671 167675 167681 167683 167689 167693 167695 167699 167705 167711 167713 167719 167723 167725 167731 167735 167741 167749 203614
| A. | 回收废旧电池 | |
| B. | 将工厂烟囱加高,减少周围大气污染 | |
| C. | 开发利用氢能源 | |
| D. | 推广使用无磷洗涤剂 |
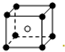
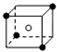
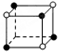
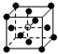
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )