题目内容
17.下列各组物质各自形成的晶体,都属于分子晶体的化合物的是( )| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
分析 化合物由两种或两种以上的元素组成的纯净物;分子间通过分子间作用力(包括范德华力和氢键)构成的晶体属于分子晶体.常见的分子晶体有:所有非金属氢化物、部分非金属单质(金刚石、晶体硅等除外)、部分非金属氧化物(二氧化硅等除外)、几乎所有的酸、绝大多数的有机物晶体等,据此判断.
解答 解:A、H2O、C3H8属于分子晶体的化合物,HD是单质,不是化合物,故A错误;
B、P2O5、CO2、H3PO4是属于分子晶体的化合物,故B正确;
C、SO2、CS2属于分子晶体的化合物,SiO2属于原子晶体,故C错误;
D、CCl4、H2O2属于分子晶体的化合物,(NH4)2S是离子晶体,不是分子晶体,故D错误.
故选:B.
点评 本题考查常见物质晶体类型判断等,难度不大,掌握常见物质晶体类型及常见分子晶体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.电解水这一变化中,没有变化的粒子是( )
| A. | 水分子 | B. | 水原子 | C. | 氢、氧两种原子 | D. | 以上都不是 |
8.原子结构示意图为的 元素是( )
元素是( )
 元素是( )
元素是( )| A. | Li | B. | Na | C. | Al | D. | K |
5.下列各组离子,能在强酸溶液中大量共存,并且溶液呈无色的是( )
| A. | Na+、Ca2+、Cl-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | NH4+、Al3+、NO3-、OH- |
9.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇中的乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
6.可以鉴别C2H5OH、C6H5OH、AgNO3、Na2CO3、氢硫酸五种物质的一种试剂是( )
| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | FeCl3溶液 | D. | 高锰酸钾溶液 |
7.有A、B、C三种短周期主族元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
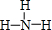 .
.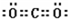 ;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.
;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.