题目内容
19.有下列8种晶体,用序号回答下列问题:A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)属于原子晶体的化合物是A,直接由原子构成的分子晶体是D.
(2)通过非极性键形成的原子晶体是G;含有共价键的离子晶体是E.
(3)分子内存在化学键,但受热熔化时,化学键不发生变化的是B、C,受热熔化,需克服共价键的是A、G.
分析 (1)原子晶体的构成微粒为原子,分子晶体的构成微粒为分子,但稀有气体形成的分子晶体由原子构成的分子;
(2)通过非极性键形成的原子晶体为单质形成的晶体,氯化铵是含有共价键的离子晶体;
(3)含有共价键的分子晶体,熔化时破坏分子间作用力,不破坏共价键,原子晶体熔化时破坏共价键.
解答 解:(1)水晶、金刚石都是原子晶体,水晶化学成分为二氧化硅,属于原子晶体的化合物,直接由原子构成的分子晶体是稀有气体D,
故答案为:A;D;
(2)通过非极性键形成的原子晶体为金刚石,含有共价键的离子晶体是氯化铵,
故答案为:G;E;
(3)冰醋酸和白磷是含有共价键的分子晶体,熔化时破坏分子间作用力,不破坏共价键,水晶和金刚石属于原子晶体,熔化时破坏共价键,
故答案为:B、C;A、G.
点评 本题考查了化学键的类型和晶体的类型及性质,为高频考点,题目具有一定的综合性,准确判断化学键类型和晶体类型是解题的关键.

练习册系列答案
相关题目
9.已知氮元素和氧元素组成的化合物中 氮元素和氧元素的质量比为7:16其化学式可能为( )
| A. | NO | B. | NO2 | C. | N2O | D. | N2O5 |
10.20℃时,NaCl溶解于水的实验数据如下表所示
下列叙述正确的是( )
| 实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
| ① | 10 | 2 | 0 |
| ② | 10 | 3 | 0 |
| ③ | 10 | 4 | 0.4 |
| A. | 实验①所得的溶液为饱和溶液 | |
| B. | 实验②所得的溶液为饱和溶液 | |
| C. | 20℃时NaCl的溶解度为30g | |
| D. | 实验①所得溶液的溶质质量分数为16.7% |
7.2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞.据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质.下列有关说法不正确的是( )
| A. | 自然界中没有游离的钠和铝 | |
| B. | 若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到水中,一定有偏铝酸钠生成 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
14.下列粒子的空间构型不是正四面体的是( )
| A. | SiH4 | B. | CH3Cl | C. | P4 | D. | NH4+ |
11.水杨酸环已酯具有花香气味,可作为香精配方.其合成路线如图:
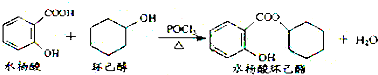
下列说法正确的是( )

下列说法正确的是( )
| A. | 水杨酸能分别与NaHCO3、Na2CO3溶液反应,且1 mol水杨酸分别消耗NaHCO32mol、Na2CO31mol | |
| B. | 水杨酸、环己醇和水杨酸环己酯均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol水杨酸环己酯在NaOH溶液中水解时,最多消耗3 mol NaOH | |
| D. | 1 mol水杨酸跟足量浓溴水反应时,最多消耗Br2 2 mol |
8.已知反应X+Y═M+N为放热反应,下列有关说法正确的是( )
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因该反应为放热反应,所以一定不必加热就可 |
 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=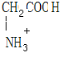 .
.