题目内容
13.(1)普通玻璃的主要原料是纯碱、石灰石和石英,窑里加强热时,纯碱与石英的反应化学方程式为Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,其中产物Na2SiO3的名称为硅酸钠,仿照这个方程式,写出石灰石(CaCO3)与SiO2加强热的反应方程式CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑(2)水体富营养化造成藻类等生物大量繁殖导致水面变色,这种现象在江河、湖泊中出现称为水化,在海湾出现叫做赤潮.
(3)写出钢铁生锈的电极反应式(水膜呈中性):
负极Fe-2e-=Fe2+ 正极O2+4e-+2H2O=4OH-总反应式Fe+2H2O+O2=2Fe(OH)2↓.
分析 (1)Na2SiO3是硅酸钠,二氧化硅与碳酸钙反应生成硅酸钙和二氧化碳;
(2)水体富营养化可导致水体污染,在淡水中称为水华,海水中称为赤潮,以此解答;
(3)钢铁在潮湿中性环境下形成以铁做负极,碳做正极的原电池,铁发生吸氧腐蚀.
解答 解:(1)Na2SiO3是硅酸钠,二氧化硅与碳酸钙反应生成硅酸钙和二氧化碳,化学方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
故答案为:硅酸钠;CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)“水华”是淡水中的一种自然生态现象,只是仅由藻类引起的,如蓝藻(严格意义上应称为蓝细菌)、绿藻、硅藻等,也就是水的富营养化.“水华”发生时,水一股呈蓝色或绿色,这种在自然界就有的“水华”现象;
赤潮又称红潮或有害藻水华,通常是指海洋微藻、细菌和原生动物在海水中过度增殖或聚集致使海水变色的一种现象;
故答案为:水化;赤潮;
(3)钢铁中较活泼金属铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+;碳作正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-;总的反应式为:Fe+2H2O+O2=2Fe(OH)2↓;
故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;Fe+2H2O+O2=2Fe(OH)2↓.
点评 本题考查了化学方程式的书写,明确硅酸盐的性质及钢铁发生吸氧腐蚀的原理是解题关键,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
3.对下列常见现象进行分析,其中发生了化学变化的是( )
| A. | 煮饭前米用水洗一洗 | B. | 冰箱中放入木炭后,异味消失 | ||
| C. | 自行车轮胎在烈日下爆裂 | D. | 食物变质 |
4.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,待到水的质量跟液态芳香烃X的质量相等,则X的分子式是( )
| A. | C10H14 | B. | C11H16 | C. | C12H18 | D. | C13H20 |
1.下列关于△H-T△S说法中正确的是( )
| A. | △H<0、△S<0的反应在任何温度下都可以自发进行 | |
| B. | 蔗糖溶于水及气体扩散过程均是熵减过程 | |
| C. | △H-T△S只用于判断温度、压强一定的反应能否自发进行 | |
| D. | △H-T△S<0的反应,在该条件下一定剧烈反应 |
5.t℃时Na2SO4的溶解度是S g,其饱和溶液密度d g•cm-3,物质的量浓度为c mol•L-1.向足量饱和溶液中,加入X g无水Na2SO4或蒸发Yg水后恢复t℃,均能获得W g芒硝晶体,下列关系式正确的是( )
| A. | c=$\frac{dS}{142(S+100)}$ mol•L-1 | B. | S=$\frac{142W}{180W+322Y}$g | ||
| C. | X=YS | D. | W=$\frac{3220X}{1420-18S}$g |
2.从某些植物树叶提取的挥发油中含有下列主要成分:
A.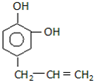 B.
B.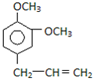 C.
C.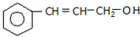
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式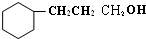 .
.
A.
 B.
B. C.
C.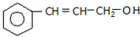
(1)2mol A与溴水充分反应,需消耗8 mol单质溴.
(2)写出B的分子式C11H14O2
(3)C与氢气完全加成后产物的结构简式
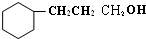 .
.
3.下列说法正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 伴有能量变化的物质变化都是化学变化 |