题目内容
15.有下列离子晶体的空间结构示意图,图中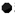 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )| A. | 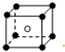 | B. | 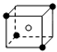 | C. | 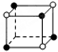 | D. | 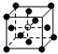 |
分析 位于体心的离子被一个晶胞占有,位于顶点上的离子被8个晶胞占有,位于面心上的离子被2个晶胞占有,利用均摊法计算晶胞中离子数目,进而确定其化学式.
解答 解:A.根据晶胞结构知,晶胞中M离子个数=8×$\frac{1}{8}$=1,N离子个数是1,所以其化学式为MN,故A符合;
B.根据晶胞结构知,晶胞中M离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,N离子个数是1,故M、N原子数目之比为1:2,则其化学式为MN2,故B不符合;
C.根据晶胞结构知,晶胞中M离子个数都是4×$\frac{1}{8}$=$\frac{1}{2}$,N离子数目为3×$\frac{1}{8}$=$\frac{3}{8}$,故M、N原子数目之比为4:3,化学式为M4N3,故C不符合;
D.根据晶胞结构知,晶胞中M离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N离子个数是1,所以其化学式为:M4N,故D不符合;
故选A.
点评 本题考查晶胞计算,比较基础,注意分析晶胞中离子或原子的分部位置,利用均摊法进行进行计算.

练习册系列答案
相关题目
5.某同学用量筒量取液体时,将量筒放平稳,倒入液体,面对刻度线,第一次仰视凹液面最低处,读数为29ml;到出部分液体后,又俯视凹液面最低处,读数为11ml,该同学倒出的液体体积是( )
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
6.下列反应离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠:Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中2Al+6H+═2Al3++3H2↑ | |
| D. | 铁跟稀盐酸反应:Fe+2H+═Fe3++H2↑ |
3.常温时,0.01mol•L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
4.某气体样品可能由H2S、H2、Cl2、SO2、CO2和O2中的一种或几种组成,进行下列实验.已知试剂过量,反应完全,“→”表示气体流向.
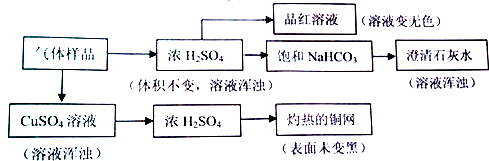
对上述实验结果,判断正确的是( )

对上述实验结果,判断正确的是( )
| A. | 能使品红溶液褪色,说明原气体样品中至少含有Cl2或SO2 | |
| B. | 灼热的铜网未变黑,说明原气体样品中一定不含有O2 | |
| C. | 澄清石灰水变浑浊,说明原气体样品中含有SO2,不能确定是否含有CO2 | |
| D. | 经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,则可排除SO2、Cl2的存在 |
5.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g2H216O中含有共用电子对数为2NA | |
| C. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 1mol N5+含有的电子数为34NA |

 ;
;