题目内容
10.如图是氮元素的几种价态与物质类别的对应关系: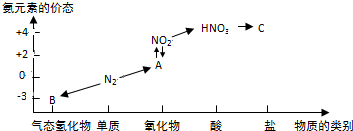
回答下列问题:
(1)写出N2的一种用途做保护气、保存粮食.
(2)HNO3与上图中的物质C常用于检验Cl-的存在,则C的化学式为AgNO3.
(3)实验室制取物质B的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)NO2与水反应生成物质A的化学方程式为3NO2+H2O=2HNO3+NO.
(5)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO. 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO.
(ⅰ) 请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,该反应中发生氧化反应的物质是Cu,1mol氧化剂得到(填“得到”或“失去”)1 mol电子.
(ⅱ) 48.0g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是C
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(ⅲ) 实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等.请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式.HNO3+FeSO4→Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+=□Fe3++□N2O↑+□H2O
(ⅳ) 硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是B
A.Cu$\stackrel{NHO_{3}}{→}$Cu(NO3)2
B.Cu$\stackrel{O_{2}}{→}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2
C.Cu$\stackrel{O_{2}}{→}$CuO$\stackrel{H_{2}O}{→}$Cu(OH)${\;}_{{\;}_{2}}$$\stackrel{HNO_{3}}{→}$Cu(NO3)2
D.Cu$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)
分析 由N元素化合价及对应物质种类,可知B为氨气、A为NO、C为硝酸盐.
(1)氮气不活泼且性质较稳定,可以做保护气;
(2)C为硝酸盐,HNO3与物质C常用于检验Cl-的存在,则C为硝酸银;
(3)B为氨气,实验室用氯化铵与氢氧化钙制备氨气,反应生成氯化钙、氨气与水;
(4)A为NO,二氧化氮与水反应生成硝酸与NO;
(5)(ⅰ) Cu与浓HNO3反应书写硝酸铜、NO2与水;所含元素化合价升高的物质发生氧化反应,氧化剂得到电子,硝酸是氧化剂,结合N元素化合价变化计算转移电子;
(ⅱ) Cu与硝酸反应生成Cu(NO3)2、NO2、NO,根据Cu元素守恒计算n[Cu(NO3)2],根据N元素守恒计算反应中消耗HNO3的物质的量;
(ⅲ) 所给的物质中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3、Fe(NO3)3;根据电子转移守恒、电荷守恒、原子守恒配平离子方程式;
(ⅳ) A.铜与硝酸反应会产生一氧化氮、二氧化氮;
B.N元素被完全利用,没有污染物生成,该途径符合绿色化学原理;
C.氧化铜与水不反应;
D.铜与稀硫酸不反应,不能制得硫酸铜;铜与浓硫酸反应会产生二氧化硫气体.
解答 解:由N元素化合价及对应物质种类,可知B为氨气、A为NO、C为硝酸盐.
(1)氮气不活泼且性质较稳定,所以可作保护气,能保存粮食,可以制备氨气等,故答案为:做保护气、保存粮食等;
(2)C为硝酸盐,用AgNO3、HNO3检验Cl-的存在,则C为硝酸银,故答案为:AgNO3;
(3)B为氨气,实验室用氯化铵与氢氧化钙制备氨气,反应生成氯化钙、氨气与水,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)A为NO,二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(5)(ⅰ) Cu与浓HNO3反应生成硝酸铜、二氧化氮和水,化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,该反应中铜元素的化合价升高,发生氧化反应,硝酸中氮元素的化合价由+5价降为+4,作氧化剂,1 mol氧化剂得到1mol电子,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu;得到;1;
(ⅱ)n(NO2)+n(NO)=$\frac{22.4L}{22.4L/mol}$=1mol,即被还原的硝酸的物质的量为1mol,48.0 g Cu的物质的量为$\frac{48g}{64g/mol}$=0.75mol,则生成n(Cu(NO3)2)=0.75mol,可知表现酸性的硝酸的物质的量为0.75mol×2=1.5mol,则参加反应的硝酸的物质的量为:1mol+1.5mol=2.5mol,故选:C;
(ⅲ) 所给的物质中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3、Fe(NO3)3,故发生的反应为:HNO3+FeSO4→Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O,配平后的离子方程式:8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O;
故答案为:FeSO4、Fe(NO3)3+Fe2(SO4)3;8、2、10、8、1、5;
(ⅳ) A.铜与硝酸反应会产生一氧化氮、二氧化氮等大气污染物,故A错误;
B.N元素被完全利用,没有污染物生成,该途径符合绿色化学原理,故B正确;
C.该流程中氧化铜与水不反应,不能制得硝酸铜,故C错误;
D.该途径中铜与稀硫酸不反应,不能制得硫酸铜;铜与浓硫酸反应会产生二氧化硫气体,污染大气,故D错误,
故选:B.
点评 本题比较综合,属于拼合型题目,涉及氮元素单质化合物的性质、氨气制备、氧化还原反应配平、化学计算、绿色化学等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,难度中等.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 向0.1 mol•L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| A. | 2:3:2 | B. | 2:3:3 | C. | 1:3:2 | D. | 3:1:2 |
| A. | HCl、MgCl2 | B. | Na2O、CO2 | C. | CaCl2、CH4 | D. | NH3、H2O |
| A. | Na+、Ca2+、Cl-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | NH4+、Al3+、NO3-、OH- |
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用热的纯碱溶液洗涤餐具上的油 | |
| C. | 用米汤检验食盐中是否含碘酸钾 | |
| D. | 用灼烧并闻气味的方法区别纯棉和纯羊毛织物 |
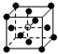
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )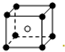
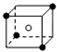
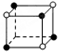
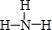 .
. ;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.
;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.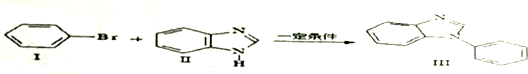
 、
、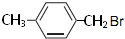 .
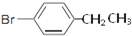
.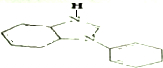 .
.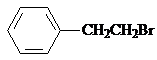 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为: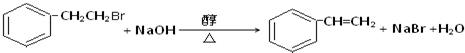 .
.