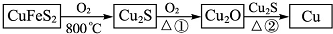题目内容
18.用“>”、“<”、“=”填空(1)第一电离能:P>S;
(2)酸性:H3PO4< H2SO4;
(3)稳定性:H2O>H2S>H2Se;
(4)微粒半径:S2->Cl->K+;S<S2-
(5)碱性:KOH>NaOH>Al(OH)3;
(6)元素的电负性:S<Cl.
分析 (1)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(3)同主族从上到下,元素的非金属性减弱,其氢化物的稳定性减弱;
(4)电子层结构相同的离子,离子半径随着原子序数的增大而减小,原子半径小于其阴离子的半径;
(5)金属的金属性越强,其最高价氧化物的水化物碱性越强;
(6)同周期从左到右元素的非金属性增强,电负性增强.
解答 解:(1)同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素,镁和铝都属于第三周期,且P是第VA族元素,S是第VIA族元素,所以第一电离能:P>S,
故答案为:>;
(2)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:P<S,所以酸性:H3PO4<H2SO4,故答案为:<;
(3)同主族从上到下,元素的非金属性减弱,其氢化物的稳定性减弱,所以稳定性:H2O>H2S>H2Se,故答案为:>;>;
(4)电子层结构相同的离子,离子半径随着原子序数的增大而减小,硫离子、氯离子和钾离子电子层结构相同,且钾原子序数大于氯元素,氯元素大于硫元素,所以微粒半径:S2->Cl->K+,原子半径小于其阴离子的半径,则S<S2-,
故答案为:>;>;<;
(5)金属的金属性越强,其最高价氧化物的水化物碱性越强,金属性:K>Na>Al,所以碱性:KOH>NaOH>Al(OH)3,故答案为:>;>;
(6)同周期从左到右元素的非金属性增强,电负性增强,则电负性:S<Cl,故答案为:<.
点评 本题考查较综合,根据元素周期律来分析解答即可,难度不大,注意第一电离能的规律及异常现象,为易错点.

| A. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| B. | 加强工业废水的排放监控,坚持达标排放 | |
| C. | 合理施用农药、化肥,以减少水体污染 | |
| D. | 淡水资源丰富,所以淡水可以取之不尽、用之不竭 |
| A. | NaCl溶液的体积 | B. | NaCl的质量分数 | ||
| C. | NaCl的物质的量 | D. | NaCl的物质的量浓度 |
| A. | 硅是非金属元素,晶体硅是灰黑色有金属光泽的固体 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| D. | 二氧化硅常被用来制造光导纤维 |
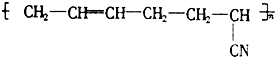 丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④
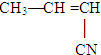 ⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.
⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S>Se.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
| A. | R元素位于第6周期,ⅢB族 | B. | R(OH)3与Al (OH)3一样是两性氢氧化物 | ||
| C. | R单质还原性比铝强 | D. | 离子半径:R3+>R+ |