7.下列说法不正确的是( )
| A. | 常温下,将CH3COONa溶液,盐酸混合后,溶液呈中性,则有c(Cl-)=c(CH3COOH) | |
| B. | 常温下将pH=2的硫酸和pH=12的氨水等体积混合,所得溶液的pH>7 | |
| C. | pH=3的醋酸溶液加水稀释后,溶液中c(CH3COO-)•c(H+)不变 | |
| D. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
6.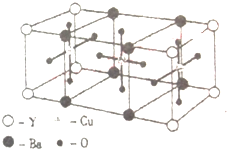 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )| A. | 该化合物的化学式是Y4Ba4Cu3O12 | B. | 该化合物的化学式是YBaCu3O6 | ||
| C. | 该化合物的化学式是Y2BaCu3O6 | D. | 该化合物的化学式是YBa2Cu3O7 |
4.下列叙述正确的是( )
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
3.物质W,Z之间有反应:4W+O2+2H2O=4Z,下列说法正确的是( )
| A. | 物质W和Z所含的元素可能相同也可能不相同 | |
| B. | 若W是一种气体,它可由氨气的催化氧化直接生成 | |
| C. | 物质W和Z所含有的某种元素,可能是地壳中或空气中含量最高的 | |
| D. | 每转移1mol电子,消耗氧气5.6L |
1.如图表示反应A(g)?4B(g)+C(g)△H<0,在某温度时A的浓度随时间变化的曲线. 达到平衡后,下列有关该反应的描述不正确的是( )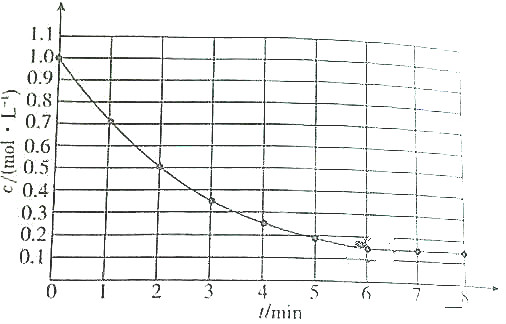
0 167503 167511 167517 167521 167527 167529 167533 167539 167541 167547 167553 167557 167559 167563 167569 167571 167577 167581 167583 167587 167589 167593 167595 167597 167598 167599 167601 167602 167603 167605 167607 167611 167613 167617 167619 167623 167629 167631 167637 167641 167643 167647 167653 167659 167661 167667 167671 167673 167679 167683 167689 167697 203614

| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
 2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.
2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内. .
.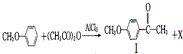
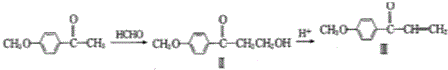
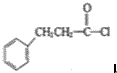 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: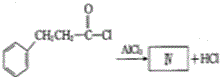
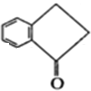 .
. .
. .
.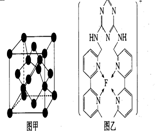 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: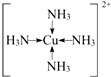 .
.