题目内容
1.如图表示反应A(g)?4B(g)+C(g)△H<0,在某温度时A的浓度随时间变化的曲线. 达到平衡后,下列有关该反应的描述不正确的是( )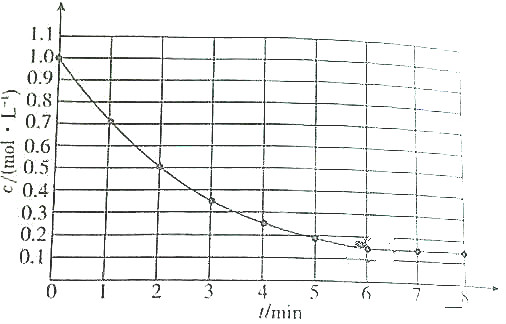
| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
分析 A.根据图象知,第6min后,A物质浓度不变,说明该反应达到平衡状态,正逆反应速率相等,处于动态平衡状态;
B.到达平衡时A浓度为0.15mol/L,△c=(1.0-0.15)mol/L=0.85mol/L,转化率=$\frac{0.85mol/L}{1.0mol/L}$×100%;
C.升高温度正逆反应速率都增大,但该反应的正反应是放热反应,升高温度平衡逆向移动;
D.降低温度正逆反应电离都减小,但平衡正向移动.
解答 解:A.根据图象知,第6min后,A物质浓度不变,说明该反应达到平衡状态,正逆反应速率相等但不是0,处于动态平衡状态,故A错误;
B.到达平衡时A浓度为0.15mol/L,△c=(1.0-0.15)mol/L=0.85mol/L,转化率=$\frac{0.85mol/L}{1.0mol/L}$×100%=85%,故B正确;
C.升高温度正逆反应速率都增大,但该反应的正反应是放热反应,升高温度平衡逆向移动,逆反应速率大于正反应速率,即生成A的平均速率大于消耗A的平均速率,故C正确;
D.降低温度正逆反应电离都减小,但平衡正向移动,生成A的平均速率和消耗A的平均速率以不同倍数减少且消耗A的平均速率大于生成A的平均速率,故D正确;
故选A.
点评 本题考查化学平衡状态的判断、化学平衡计算、化学平衡移动及反应速率影响因素,侧重考查分析计算能力,注意平衡状态时反应速率不是0,会根据方程式特点判断平衡移动方向及反应速率变化趋势,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
11. 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )| A. | M点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | W,M两点Y的正反应速率相等 |
12.磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂.将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是( )
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
9.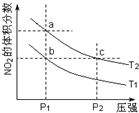 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
6.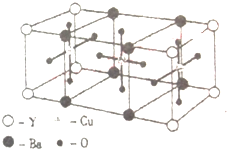 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )| A. | 该化合物的化学式是Y4Ba4Cu3O12 | B. | 该化合物的化学式是YBaCu3O6 | ||
| C. | 该化合物的化学式是Y2BaCu3O6 | D. | 该化合物的化学式是YBa2Cu3O7 |
7.自来水厂生产自来水的工艺流程示意图如图所示

“加氯”是指加入含有氯元素的物质,该物质可以是( )

“加氯”是指加入含有氯元素的物质,该物质可以是( )
| A. | 氯气 | B. | ClO2 | C. | NaCl | D. | NaClO3 |