题目内容
4.下列叙述正确的是( )| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
分析 A.醋酸为弱酸,浓度影响醋酸的电离程度,如:浓度越大,电离程度越小;
B.反应后溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,c(OH-)>c(H+);
C.根据亚硫酸氢钠溶液中的物料守恒分析;
D.根据酸式盐NaHA溶液中电荷守恒和物料守恒进行判断.
解答 解:A.醋酸溶液中,醋酸是弱电解质,醋酸浓度越大其电离程度越小,所以两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2,故A错误;
B.10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,二者恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),结合电荷守恒可得:c(Na+)>c(CH3COO-),溶液中正确的离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.在0.1mol•L-1NaHSO3溶液中,根据物料守恒可得:c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故C正确;
D.pH<7的某二元弱酸的酸式盐NaHA溶液中,溶液显示酸性,HA-的水解程度小于电离程度,即c(A2-)>c(H2A);根据电荷守恒可得:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),根据物料守恒可得:c(Na+)=c(A2-)+c(H2A)+c(HA-),两个平衡结合可得:①c(H+)+c(H2A)=c(OH-),若②c(H+)+2c(A2-)═c(OH-)+c(H2A),①-②可得:c(A2-)=c(H2A),而实际上c(A2-)>c(H2A),故D错误;
故选C.
点评 本题考查了溶液中离子浓度大小分析,题目难度中等,明确电荷守恒、物料守恒的应用方法为解答关键,要求学生能够利用电荷守恒、物料守恒及盐的水解比较溶液中离子浓度大小.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案| A. | 常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大 | |
| C. | 常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14 | |
| D. | 等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同 |
| A. | 为了使燃料充分燃烧,通入的空气要适当过量 | |
| B. | 目前锅炉燃烧采用沸腾炉的逐渐增多,目的是提高煤炭的热效率并减少SO2的排放 | |
| C. | 为提高热能的利用率,可以在煤燃烧后排放废气的烟道中安装热交换装置 | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
| A. | 改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4amol | |
| C. | 参加反应的氯气的物质的量3amol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=6,则溶液中$\frac{c(C{l}^{-})}{c(C{O}_{3}^{-})}=\frac{1}{2}$ |
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: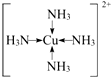 .
.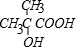 ;b 的结构简式
;b 的结构简式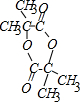 .
.