题目内容
19. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序C<O<N.
(2)下列说法错误的是ACD.
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物低(填“高”或“低”),原因是Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小.
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm.
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.
①F原子的外围电子排布式为3d104s1,向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为
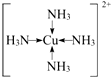 .
.②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子,该离子中碳原子的杂化方式有sp2、sp3.
分析 现有A、B、C、D、E、F原子序数依次增大的六种元素,均位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,二者只能处于第四周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,F为Cu,据此解答.
解答 解:现有A、B、C、D、E、F原子序数依次增大的六种元素,均位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,二者只能处于第四周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,F为Cu.
(1)C、N、O同周期,随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N,故答案为:C<O<N;
(2)A.二氧化硅属于原子晶体,二氧化碳形成分子晶体,故点:SiO2>CO2,故A错误;
B.同周期自左而右电负性增大,故电负性顺序:C<N<F,故B正确;
C.N2与CO为等电子体,氮气分子中N原子之间形成3对共用电子对,化学性质稳定,CO还原性较强,二者化学性质不同,故C错误;
D.水分子间存在氢键,影响物理性质,不影响化学性质,由于非金属性O>S,所以稳定性:H2O>H2S,故D错误,
故选:ACD;
(3)Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小,FeO的熔点比Fe2O3低,
故答案为:低;Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小;
(4)晶胞中C原子数目=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,晶胞质量=8×$\frac{12}{{N}_{A}}$g=$\frac{96}{{N}_{A}}$g,若晶体的密度为ρg/cm3,则晶胞体积=$\frac{96}{{N}_{A}}$g÷ρg/cm3=$\frac{96}{ρ{N}_{A}}$=cm3,则晶胞棱长=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,C原子与周围4个C原子形成正四面体,正四面体中心碳原子与正四面体顶点碳原子相邻,正四面体的棱长a=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm×$\frac{\sqrt{2}}{2}$,斜面高为=$\frac{\sqrt{3}}{2}$a cm,底面中心到边的距离为$\frac{\sqrt{3}}{2}$a×$\frac{1}{3}$ cm,设中心碳原子到顶点碳原子距离为x cm,则中心碳原子到底面面心距离为$\frac{x}{3}$ cm,故正四面体的高为(x+$\frac{x}{3}$ )cm,则:(x+$\frac{x}{3}$ )2+($\frac{\sqrt{3}}{2}$a×$\frac{1}{3}$ )2=($\frac{\sqrt{3}}{2}$a)2,整理得x=$\frac{\sqrt{6}}{4}$a,及x=$\frac{\sqrt{6}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$×$\frac{\sqrt{2}}{2}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$.
(5)①F为Cu,原子的外围电子排布式为3d104s1 ,C与A形成的气体N,则A为H元素,N为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,铜离子与氨气分子之间形成配位键,N原子提供孤对电子,该离子的结构式为: ,
,
故答案为:3d104s1 ; ;
;
②杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,甲基、亚甲基上碳原子含有4个共价单键,采用sp3杂化,故答案为:sp2、sp3.
点评 本题是对物质结构的考查,涉及核外电子排布、电负性、配合物、杂化理论、晶胞计算等,(4)中计算为易错点、难点,需要学生理解晶胞结构,具备一定的空间想象与数学计算能力,注意理解均摊法进行晶胞有关计算,难度中等.

 名校课堂系列答案
名校课堂系列答案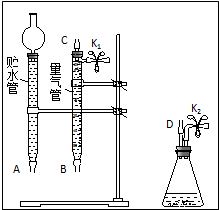 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:
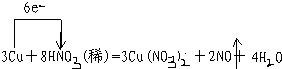 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度)下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止.
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
| A. | Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O | |
| B. | Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O | |
| D. | Ca2++CO32-→CaCO3↓ |

| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)-115.6 kJ | |
| D. | 若反应生成2mol液态水,放出的热量高于115.6kJ |
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
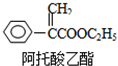
| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
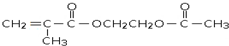 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
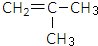 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.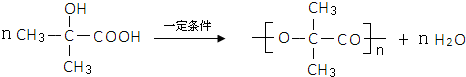 ;
;