题目内容
7.下列说法不正确的是( )| A. | 常温下,将CH3COONa溶液,盐酸混合后,溶液呈中性,则有c(Cl-)=c(CH3COOH) | |
| B. | 常温下将pH=2的硫酸和pH=12的氨水等体积混合,所得溶液的pH>7 | |
| C. | pH=3的醋酸溶液加水稀释后,溶液中c(CH3COO-)•c(H+)不变 | |
| D. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
分析 A.溶液呈中性,c(H+)=c(OH-),根据混合液中的物料守恒和电荷守恒分析;
B.氨水为弱碱,混合液中氨水过量,溶液显示酸性;
C.醋酸稀释过程中,醋酸的电离平衡常数不变,而c(CH3COO-)•c(H+)=Ka×c(CH3COO-);
D.亚硫酸钠溶液中,亚硫酸根离子水解,溶液显示碱性,加入氢氧化钠溶液后,氢氧根离子抑制了亚硫酸根离子的水解,导致溶液中亚硫酸根离子浓度增大.
解答 解:A.溶液呈中性,c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-)可得:c(Na+)=c(Cl-)+c(CH3COO-),溶液中存在物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH),二者结合可得:c(Cl-)=c(CH3COOH),故A正确;
B.常温下将pH=2的硫酸和pH=12的氨水等体积混合,氨水为弱碱,则混合液中氨水过量,溶液显示酸性,所得溶液的pH<7,故B错误;
C.根据电离平衡常数表达式可知:c(CH3COO-)•c(H+)=Ka×c(CH3COO-),此时过程中电离平衡常数不变,但是醋酸的浓度减小,所以c(CH3COO-)•c(H+)的积会减小,故C错误;
D.向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)会增大,溶液中氢氧根离子浓度增大,抑制了亚硫酸根离子的水解,导致溶液中c(SO32-)增大,故D正确;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,注意明确盐的水解原理、电荷守恒、物料守恒的应用,熟练掌握判断离子浓度大小常用方法,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
18.含不溶杂质的NaN03样品,加入一定量蒸馏水使其充分溶解,情况如表:
NaNO3溶解度(g/100g水)如表:
(1)实验中加入的水为300g;
(2)原样品中NaN03为372g.
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
(2)原样品中NaN03为372g.
19.下列对有关元素的叙述能说明该元素一定是主族元素的是( )
| A. | N层比M层少8个电子的元素 | B. | L层比M层多一个电子的元素 | ||
| C. | 最高价为+6价的元素 | D. | 无负化合价的元素 |
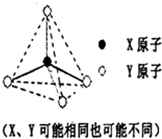
16.请根据短周期元素在元素周期表中的位置,结合所提供的图表回答下列问题:
(1)元素周期表第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是离子晶体,
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).

13.水是生命之源,保护水资源、节约用水是我们义不容辞的责任.下图所表示的做法不能节约用水的是( )
| A. |  浴擦肥皂时,暂时关上喷头 | B. |  洗衣后的水用来拖地 | ||
| C. |  水龙头坏了,立即进行修理 | D. |  用水管不间断地冲洗汽车 |
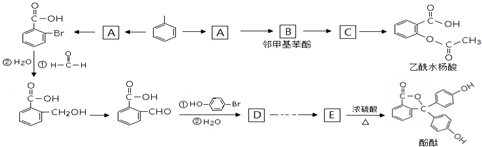
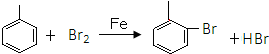 .
.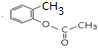 ,E分子中的含氧官能团名称为羧基、羟基;
,E分子中的含氧官能团名称为羧基、羟基;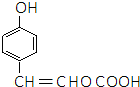 或
或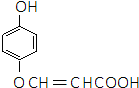 的邻、间、对的任意一种.
的邻、间、对的任意一种.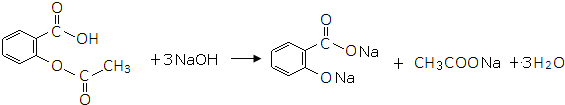 .
.