题目内容
2.在25℃时一元强酸与一元强碱混合,填写下列空白.(1)若1体积的某强酸与10体积的某强碱混合后,溶液呈中性,则混合前,强酸的pH与强碱的pH之间满足的关系是pH1+pH2=13.
(2)若强酸与强碱的pH之和为13,混合后溶液呈中性,则两者体积之比为1:10.
(3)若强酸与强碱的pH之和为14,且等体积混合,则混合后溶液呈中性.
分析 (1)pH=-lgc(H+),25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,设出酸溶液的pH为a,碱溶液的pH为b,根据该温度以及体积关系列式计算;
(2)设强酸溶液的pH为a,体积为V1,碱溶液的pH为b,体积为V2,常温下,PH=a的强酸溶液中氢离子浓度为10-a mol/L,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量;
(3)设强酸溶液的pH为a,碱溶液的pH为b,a+b=14,等体积混合,根据混合后氢离子、氢氧根离子的物质的量的相对大小判断溶液的酸碱性;
解答 解:(1)设强酸溶液的pH为a,体积为V,pH=-lgc(H+),溶液中氢离子浓度为:10-amol/L;碱溶液的pH为b,体积为10V,溶液中氢氧根离子的浓度为:c(OH-)=10-(14-b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10-amol/L×VL=10-(14-b)mol/L×10VL,
解得:-a=b-13,a+b=13,即pH1+pH2=13,
故答案为:pH1+pH2=13;
(2)常温下,PH=a的强酸溶液中氢离子浓度为10-a mol/L,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以V1×10-a=V2×10 b-14,a+b=13,解得:V1:V2=1:10,
故答案为:1:10;
(3)常温下,PH=a的强酸溶液中氢离子浓度为10-a mol/L,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol/L,a+b=14,氢氧根离子浓度为10 b-14 mol/L=10-amol/L,等体积混合,设体积为V,则10-amol/L×VL=10-(14-b)mol/L×VL,混合后溶液呈中性,
故答案为:中;
点评 本题考查了酸碱混合溶液定性判断,明确溶液的pH与氢离子、氢氧根离子浓度的关系是解本题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| | X | | Y | |
| R |
| A. | 五种元素中原子半径最大的是W,离子半径最大的是R离子 | |
| B. | X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X | |
| C. | Y与Z形成的化合物一定是碱性氧化物 | |
| D. | Z与W形成的化合物水溶液可能显酸性 |
| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
| A. | 1L0.1mol•L-1碳酸钠溶液中的阴离子总数为0.1NA | |
| B. | 将400mL1mol/L的HNO3溶液与7gFe粉充分反应,电子转移数为0.375NA | |
| C. | 标准状况下,14g氦气中共用电子对的数目为1.5NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8kJ/mol的转化率为30%,当放出91.8kJ热量时,生成氨分子的数目为0.6NA |
| A. | 常温下,将CH3COONa溶液,盐酸混合后,溶液呈中性,则有c(Cl-)=c(CH3COOH) | |
| B. | 常温下将pH=2的硫酸和pH=12的氨水等体积混合,所得溶液的pH>7 | |
| C. | pH=3的醋酸溶液加水稀释后,溶液中c(CH3COO-)•c(H+)不变 | |
| D. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
| A. | ④>②>③>① | B. | ①>②>③>④ | C. | ①>②>④>③ | D. | ①>③>②>④ |
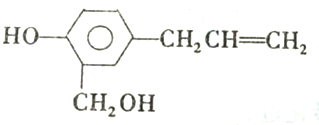 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )| A. | 等量A分别与Na和NaOH反应消耗二者的物质的量相同 | |
| B. | 1 mol A 可与2 mol Br2发生取代反应 | |
| C. | A与Na2CO3反应可放出CO2 | |
| D. | 1 mol A 可与4 mol H2发生反应 |
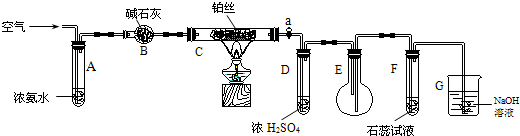
| A. | C不需要持续加热 | |
| B. | D的作用是干燥气体 | |
| C. | B是无用装置 | |
| D. | 仅用该套装置和药品无法达到检验产物的目的 |