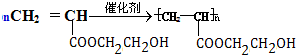题目内容
6. 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )| A. | 该化合物的化学式是Y4Ba4Cu3O12 | B. | 该化合物的化学式是YBaCu3O6 | ||
| C. | 该化合物的化学式是Y2BaCu3O6 | D. | 该化合物的化学式是YBa2Cu3O7 |
分析 由晶胞结构可知,Y原子位于顶点,Ba原子位于棱上,Cu原子位于晶胞内部,O原子晶胞内部与面上,利用均摊法计算原子数目,进而确定化学式.
解答 解:由晶胞结构可知,Y原子位于顶点,晶胞中Y原子数目为8×$\frac{1}{8}$=1,
Ba原子位于棱上,晶胞中Ba原子数目为8×$\frac{1}{4}$=2,
Cu原子位于晶胞内部,晶胞中Cu原子数目为3,
O原子晶胞内部与面上,晶胞中O原子数目为2+10×$\frac{1}{2}$=7,
故该晶体化学式为YBa2Cu3O7,
故选D.
点评 本题考查晶胞有关计算,注意利用均摊法进行计算,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列有关化学概念或原理的论述中正确的是( )
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
1.如图表示反应A(g)?4B(g)+C(g)△H<0,在某温度时A的浓度随时间变化的曲线. 达到平衡后,下列有关该反应的描述不正确的是( )

| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
18.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Na+、Cl?、S2?、AlO2- | |
| B. | c(H+):c(OH-)=1:1012的溶液中Mg2+、Cu2+、Fe2+、SO42-、Cl?、NO3-可以大量共存 | |
| C. | pH=8的溶液中可能大量存在Na+、K+、Ba2+、Cl-、HCO3-、NO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Al3+、Cl-、SO42-、NO3- |
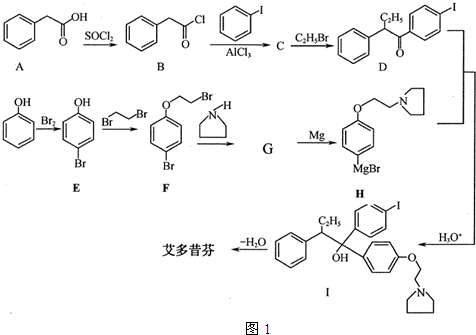
 ; 艾多昔芬
; 艾多昔芬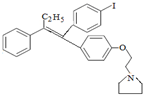 .
.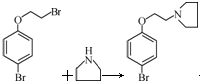 +HBr
+HBr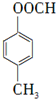 .
.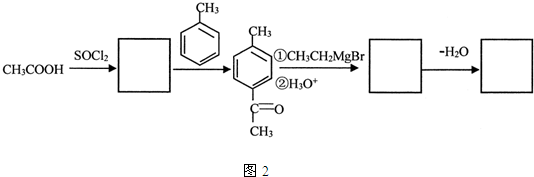
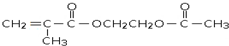 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
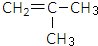 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.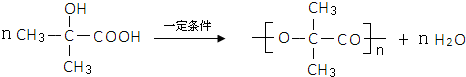 ;
;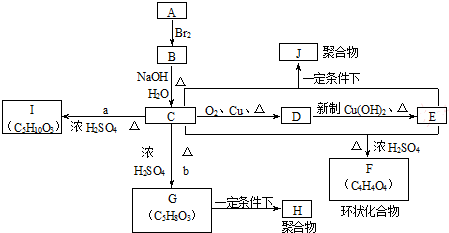
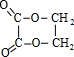 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.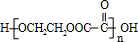 +(2n-1)H2O
+(2n-1)H2O