题目内容
5.一定量的甲烷完全燃烧后得到的产物CO、CO2、和水蒸气.测得此混合气体的质量为59.2g.将此混合气体通过足量的浓硫酸,浓硫酸增重28.8g.原混合气体中CO的质量为8.4g,CO2的质量为22g.分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水浓硫酸时,浓硫酸增重的28.8g为水的质量,所以一氧化碳和二氧化碳的质量为:59.2g-28.8g=30.4g;
根据H原子守恒可计算CH4的质量,根据C原子守恒可计算CO、CO2的总的物质的量;
设CO、CO2的物质的量分别为xmol、ymol,根据上述分析列方程计算x、y的值,根据m=nM计算CO、二氧化碳的质量.
解答 解:浓硫酸增重的28.8g为水的质量,则水的物质的量为:n(H2O)=$\frac{28.8g}{18g/mol}$=1.6mol,
根据H原子守恒可计算CH4的物质的量为n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.6mol=0.8mol,
根据C原子守恒可知CO和CO2的总的物质的量为0.8mol,
由于水的质量为28.8g,一氧化碳和二氧化碳的质量为:59.2g-28.8g=30.4g,
设CO、CO2的物质的量分别为xmol、ymol,则:x+y=0.8mol、28x+44y=30.4,
解得:x=0.3,y=0.5,
所以原混合气中CO的质量为:0.3mol×28g/mol=8.4g,二氧化碳的质量为:44g/mol×0.5mol=22g,
故答案为:8.4g;22g.
点评 本题考查有机物燃烧反应的计算,题目难度中等,注意明确质量守恒定律在化学计算中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
13.向含1mol NaOH、2mol NaAl(OH)4、1mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述正确的是( )
| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
11.下列各种说法中,不正确的是( )
| A. | 物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液、水的电离程度的大小顺序是①>②>③ | |
| B. | 将100mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(NH4+)/c (NH3•H2O)先增大再减小 | |
| D. | 等物质的量的二元弱酸H2X与其钾盐K2X-的混合液中:c(K+)=c(H2X)+c(HX-)+c(X2-) |
 +(CH3CO)2O→
+(CH3CO)2O→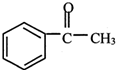 +CH3COOH
+CH3COOH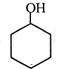 ; B
; B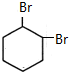
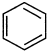 直接制取
直接制取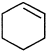 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.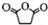 +
+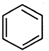 →
→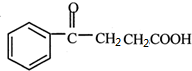 .
.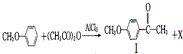
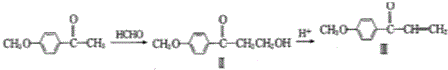
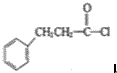 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: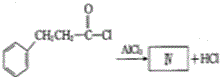
 .
. .
. .
.