11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
10.常温下,将NO和O2两种气体按物质的量1:3混合,则其平均相对分子质量是( )
| A. | 40.7 | B. | 46 | C. | 36 | D. | 44 |
9.已知A、B、C、D、E是短周期中原子序数一次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
8.化学与社会、生活、生产密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
6.为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
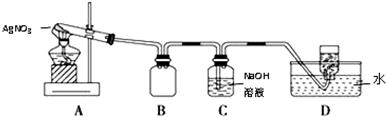
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.

5.下列有机化合物分子中的所有碳原子不可能处于同一平面的是.
| A. | 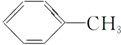 | B. | HC≡C-CH3 | ||
| C. | 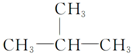 | D. |  |
2.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol•L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
0 167415 167423 167429 167433 167439 167441 167445 167451 167453 167459 167465 167469 167471 167475 167481 167483 167489 167493 167495 167499 167501 167505 167507 167509 167510 167511 167513 167514 167515 167517 167519 167523 167525 167529 167531 167535 167541 167543 167549 167553 167555 167559 167565 167571 167573 167579 167583 167585 167591 167595 167601 167609 203614
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.
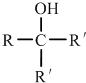
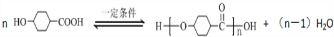
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.