题目内容
7. 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.(1)仪器A的名称为分液漏斗,干燥管D的作用是防止倒吸.
(2)现有稀硝酸、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明酸性:
HNO3>H2CO3>H2SiO3,A中装的试剂是稀硝酸,B中装的试剂是碳酸钙,C中装的试剂是硅酸钠溶液,C中的实验现象为有白色沉淀生成,写出C中开始时发生反应的离子方程式SiO32-+CO2+H2O=H2SiO3↓+CO32-.
分析 (1)仪器A是分液漏斗;有缓冲作用的装置能防止倒吸;
(2)利用强酸制取弱酸规律知,硝酸和碳酸钙反应制取二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,从而确定酸性强弱顺序HNO3>H2CO3>H2SiO3;C中硅酸根离子和二氧化碳、水反应生成难溶性的硅酸.
解答 解:(1)仪器A是分液漏斗,导致的干燥管下口小、上口大,所以有缓冲作用,能防止倒吸,
故答案为:分液漏斗;防止倒吸;
(2)利用强酸制取弱酸规律知,硝酸和碳酸钙反应制取二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,从而确定酸性强弱顺序HNO3>H2CO3>H2SiO3,所以A中盛放稀硝酸、B中盛放碳酸钙、C中盛放硅酸钠,C中硅酸根离子和二氧化碳、水反应生成难溶性的硅酸,所以看到的现象是有白色沉淀生成,离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,当二氧化碳过量时生成碳酸氢钠,
故答案为:稀硝酸;碳酸钙;硅酸钠溶液;有白色沉淀生成;SiO32-+CO2+H2O=H2SiO3↓+CO32-.
点评 本题以酸的强弱判断为载体考查性质实验方案设计,明确物质的性质及实验原理是解本题关键,侧重考查学生实验分析、操作能力,该题美中不足之处为:硝酸具有挥发性,导致生成的二氧化碳中含有硝酸而影响实验,最好在通入硅酸钠溶液之前有个盛有饱和碳酸氢钠的洗气装置,题目难度不大.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
18.标准状况下,气态分子断开1mol化学键所需的能量称为键能.已知H-H,H-O,和O═O键的键能分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
15.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向苯酚的浓溶液中加入溴水,无沉淀产生 | 苯酚与溴水不反应 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 | 使溶液褪色的气体只是乙烯 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
2.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol•L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物).下列说法正确的是( )
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
19.应用元素周期律分析,下列推断正确的是( )
| A. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 |

 .
. 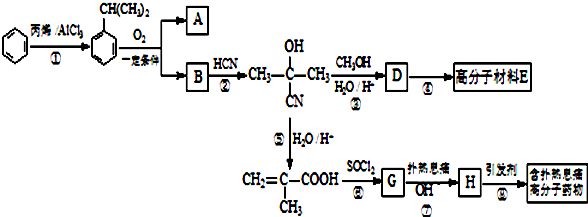

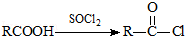
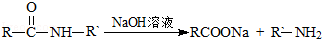
 可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式:
可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式: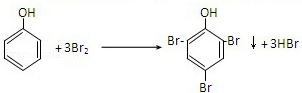 ;
;  ;扑热息痛的结构简式为
;扑热息痛的结构简式为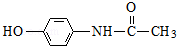 .
.